
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
分析 ①硫单质点燃生成二氧化硫,碳酸酸性弱于亚硫酸,二氧化硫气体入氯化钡溶液中不反应;
②硫酸铜和过量氢氧化钠溶液反应生成氢氧化铜悬浊液,加入葡萄糖加热反应反应氧化反应生成红色沉淀氧化亚铜;
③饱和食盐水中依次通入氨气、二氧化碳会反应生成碳酸氢钠晶体,碳酸氢钠受热分解生成碳酸钠;
④氧化铁和盐酸反应生成氯化铁溶液,加热蒸发促进氯化铁水解正向进行,得到氢氧化铁固体,灼烧分解生成氧化铁.
解答 解:①硫单质点燃生成二氧化硫,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,碳酸酸性弱于亚硫酸,二氧化硫气体入氯化钡溶液中不反应,不能生成硫酸钡沉淀,不能实现转化,故①错误;
②硫酸铜和过量氢氧化钠溶液反应生成氢氧化铜悬浊液,加入葡萄糖加热反应,发生氧化反应生成红色沉淀氧化亚铜,检验醛基的存在,过程能实现,故②正确;
③饱和食盐水中依次通入氨气=二氧化碳会反应生成碳酸氢钠晶体,NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,碳酸氢钠受热分解生成碳酸钠,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2+H2O,能一步实现,故③正确;
④氧化铁和盐酸反应生成氯化铁溶液,氯化铁溶液中水解生成盐酸和氢氧化铁,加热蒸发氯化氢挥发促进氯化铁水解正向进行,得到氢氧化铁固体,灼烧分解生成氧化铁,不能得到无水氯化铁,不能实现转化,故④错误;
故选B.
点评 本题考查了硫、铜、铁及其化合物性质分析,主要是反应产物的判断,注意盐类水解的分析判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
 合成氨工业对工、农业生产和国防都有重要意义.
合成氨工业对工、农业生产和国防都有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鱼虾放久了会产生不愉快的腥臭气味,应当用水冲洗,并在烹调时加人少量食醋 | |
| B. | “酸可除锈”“洗涤剂可去油”都是发生了化学变化 | |
| C. | 被蜂蚁蜇咬会感到疼痛难忍,这是蜂蚁咬人时将甲酸注人人体的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 煤酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可以使蛋白质发生变性凝固 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
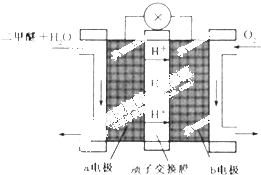 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
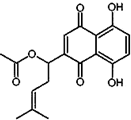 乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )
乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )| A. | 该分子中含有1个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol 乙酰紫草素最多可与2molBr2反应 | |
| D. | 1mol乙酰紫草素最多可与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L 0.1mol•L-1戊溶液中阴离子总的物质的量大于0.1mol | |
| B. | 将足量甲加入到酚酞试液中,溶液先变红后褪色 | |
| C. | X与W构成的化合物、戊、己均为离子化合物 | |
| D. | W的简单离子半径大于Z的简单离子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
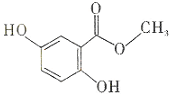
| A. | 分子式为C8H6O4 | B. | 所有的碳原子可能在同一平面内 | ||
| C. | 能发生消去反应 | D. | 能通过加聚反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com