
下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
|
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 |
|
| C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇分子中不同的化学键如图: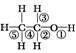 ,关于乙醇在各种反应中断裂键的说法不正确的是( )
,关于乙醇在各种反应中断裂键的说法不正确的是( )
A.乙醇和钠反应,键①断裂
B.在Ag催化下和O2反应,键①③断裂
C.乙醇和浓H2SO4共热140℃时,键①或键②断裂;在170℃时,键②⑤断裂
D.乙醇完全燃烧时断裂键①②
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明的强酸性溶液中,能大量共存的是( )
A.Na+、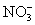 、Al3+、Cl-
、Al3+、Cl-
B.Na+、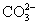 、K+、
、K+、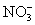
C.Cu2+、K+、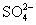 、Cl-
、Cl-
D.Ba2+、K+、Cl-、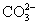
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列8种物质:①Na2CO3、②NaHCO3、③HCl、④NH4HCO3、⑤C2H5OH、⑥Al、⑦食盐水、⑧CH3COOH。
(1)上述物质中属于强电解质的是 (填序号),既能跟盐酸反应又能跟NaOH溶液反应的是 (填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示) 。
(3)④与足量的NaOH浓溶液在加热条件下反应的离子方程式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
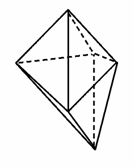
碘元素有多种价态,可能形成多种含氧阴离子IxO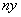 。由2个IO
。由2个IO 正八面体共用一个面形成的IxO
正八面体共用一个面形成的IxO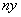 的化学式为( )
的化学式为( )
A.I2O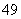 B.I2O
B.I2O
C.I2O D.I2O
D.I2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)金属导电靠________,电解质溶液导电靠________。
(2)影响金属键强弱的因素有_______________、_______等。一般说来,金属键越强,则金属的熔点________,硬度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
298K、10lkPa时,1molH2(g)与O2(g)完全反应生成H2O(g)时放出242kJ热量,而生成H2O(1)时放出286kJ热量,则下列表达不正确的是( )
|
| A. | 2H2(g)+O2(g)=2H2O(g);△H=﹣484kJ•mol﹣1 |
|
| B. | H2O(g)=H2(g)+ |
|
| C. | H2(g)+ |
|
| D. | H2O(1)=H2O(g);△H=﹣44kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一固定体积的密闭容器中,可逆反应,nA(g)+mB (g)⇌pC(g)已经达到平衡状态.已知n+m>p,正反应为放热反应.下列分析结论中正确的是( )
①升温,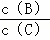 的值变小;
的值变小;
②降温,平衡体系内混合气体的平均相对分子质量变小;
③增加B的物质的量,A的转化率增大;
④使用催化剂,气体总的物质的量不变;
⑤加压使密闭容器的容积变小,A或B的浓度则变大;
⑥若A的反应速率为v(A),则v(B)=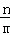 [v(A)].
[v(A)].
|
| A. | ①② | B. | ②③④ | C. | ③④⑤ | D. | ③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com