
 NH
NH +OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )
+OH-要使平衡向左移动,同时使OH-离子浓度增大,应加入下列的( )| A.NaOH固体 | B.NH4Cl固体 |
| C.H2SO4 | D.H2O |
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.①与②比较:c(Na+)>c(NH4+) |
| B.①中离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.①和②等体积混合的溶液中:c(Cl-)=c(Na+)+c(NH4+)+c(NH3·H2O) |
| D.向③中滴加适量醋酸溶液,使溶液pH=7,则:c(CH3COO-)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中导电粒子的数目增加 |
B.溶液中 不变 不变 |
| C.醋酸的电离程度增大,但电离平衡常数Ka不变 |
| D.再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.0.1 mol·L-1的醋酸溶液加水稀释, 减小 减小 |
| B.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
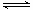 NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )| A.适当升高温度 | B.加入水 | C.通入NH3 | D.加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下0.1 mol·L-1的HA溶液pH为5 |
| B.常温下NaA溶液的pH>7 |
| C.HA溶液中存在H+、OH-、A-、HA |
| D.HA溶液能与大理石反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )
H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )| A.①④⑤ | B.②⑤⑥ | C.①④ | D.②③⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
 2H++S
2H++S查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com