
【题目】纳米孔气凝胶保温毡是由二氧化硅气凝胶和玻璃纤维组成的复合保温材料,该材料具有保温性能好、防火性能卓越、稳定性高等优点。下列说法不正确的是( )
A.该材料能溶于水
B.该材料对铁质管道没有腐蚀性
C.二氧化硅可用来制造光导纤维
D.用激光笔照射二氧化硅气凝胶可产生丁达尔效应
科目:高中化学 来源: 题型:
【题目】用浓氯化铵溶液处理过的舞台幕布不易着火.其原因是( )
①幕布的着火点升高
②幕布的质量增加
③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔绝了空气.
A.①②
B.③④
C.①③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物。试根据以上叙述回答:
(1)元素名称:A__________,B____________,C_____________。
(2)D元素位于周期表中__________周期_________族,它的最高价氧化物对应的水化物的化学式是____________________。
(3)写出AB2与C2B2反应的化学方程式:____________________。
(4)写出D元素的最高价氧化物的水合物的浓溶液与A单质共热反应的化学方程式_________________。若要设计实验验证该反应产物,则验证的产物顺序是_____________(填写产物的化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C 计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
I.C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________。
CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________。
a.容器内混合物的质量不变 b.H2与H2O(g)的物质的量之比不再变化
c.混合气体的密度不再变化 d.形成 a mol H-H键的同时断裂 2 amol H-O键
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
压强 温度 | p1/Mpa | p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
由表中数据判断:p1 ______ p2(填“>”、“<”或“=”)
下列图像正确的是_________。
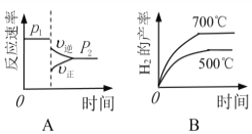
(3)已知反应Ⅱ的△H= -41.1 kJ/mol, C=O、O-H、H-H的键能分别为803kJ/mol,464 kJ/mol、436 kJ/mol,则 CO中碳氧键的键能为___________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡向_____________(填“正反应”、“逆反应”)方向移动;当重新平衡后,CO2浓度_________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
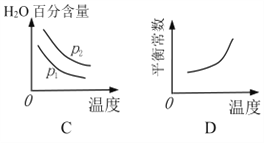
【题目】甲醇是重要的化工原料和燃料。将CO2与含少量CO的H2混合,在恒容密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1是在两种投料比[c(CO2)/c(H2+CO)]分别为1:4 和1:6 时,CO2平衡转化率随温度变化的曲线,图2 是生成的甲醇/过氧化氢燃料电池的工作原理示意图:
下列有关说法正确的是( )
A. 图2中电极M上发生还原反应
B. 图2中电极N的反应式:H2O2+2e+2H+=2H2O
C. 图1中b点对应的平衡常数K值大于c点
D. 图1中a点对应的H2的转化率等于30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2xH2O,工艺流程如下图所示。
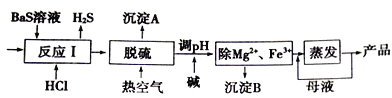
已知: 室温时Ksp[Mg(OH)2]= 1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38,请回答下列问题:
(1)写出氯化钡的电子式______,盐酸和硫化钡反应的化学方程式为___________。
(2)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为_______________________。
(3)沉淀A的成分是__________。
(4)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________________。
(5)室温时,若加碱调溶液pH至9,则完全沉淀的离子是_____________(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com