
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是 。
(2)调节pH,实验记录如下:
实验 | pH | 现象 |
A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据实验现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:
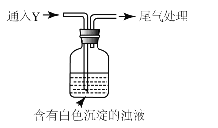
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
【答案】(1)亚硫酸根离子和银离子。(2)①2Ag++SO32-=Ag2SO3↓。②亚硫酸根有还原性,若被氧化为硫酸根离子,即可与银离子结合生成硫酸银沉淀。(3)过量亚硫酸钠。(4)①判断X是否是氧化银。②有还原性,含有银元素,不含硫元素。③Ag+2HNO3(浓)=AgNO3+NO2↑+H2O。(5)①二氧化硫。②Ag2SO3+H2O![]() 2Ag+H2SO4
2Ag+H2SO4
【解析】
(1)①推测a中白色沉淀为Ag2SO3, Ag+与SO32-反应生成Ag2SO3, Ag2SO3溶于过量的 Na2SO3溶液,生成沉淀的离子方程式为: 2Ag++SO32-=Ag2SO3↓;正确答案: 2Ag++SO32-=Ag2SO3↓。
②推测a中白色沉淀为Ag2SO4,其根据为SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成 Ag2SO4白色沉淀;正确答案:SO32-有还原性,若被氧化为SO42-,即可与Ag+结合生成Ag2SO4沉淀。
(2)Ag2SO3白色,难溶于水,溶于过量Na2SO3溶液,取B、C中白色沉淀,置于Na2SO3溶液中,沉淀溶解,说明B、C中白色沉淀为Ag2SO3;另取Ag2SO4固体,同样条件置于足量 Na2SO3溶液中,进行对照试验,发现沉淀不溶解;正确答案: 过量Na2SO3。
(3)①氧化银能和盐酸生成白色氯化银沉淀和水, 溶液的pH=2,产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X,向X中滴加稀盐酸,无明显变化,说明X不是Ag2O;正确答案:检验X是否为Ag2O 。
②向X中加入过量浓HNO3,产生红棕色气体为NO2,X与浓硝酸发生氧化还原反应,X具有还原性,X只能为金属单质,只能为银;因此X中含有Ag元素,不含S元素;正确答案:有还原性; 含有Ag元素,不含S元素。
③向X中加入过量HNO3(浓),产生红棕色气体为NO2,银和硝酸反应,氮元素从+5变为+4价,同时生成硝酸银和水,反应方程式为: Ag+2HNO3(浓)=AgNO3+NO2↑+H2O;正确答案:Ag+2HNO3(浓)=AgNO3+NO2↑+H2O。
(4)①海绵状棕黑色物质X为Ag;随着酸性的增强,+4价硫的还原性增强,能被+1价银氧化;可通过+4价硫的氧化物二氧化硫进行实验确认,通入二氧化硫后,瓶中白色沉淀Ag2SO3转化为棕黑色Ag;正确答案是: SO2。
②X为Ag,白色沉淀转化为Ag,在酸性条件下,亚硫酸银中+4价的硫,被+1价银氧化生成银和硫酸,反应为: Ag2SO3+ H2O![]() 2Ag+H2SO4;正确答案:Ag2SO3+ H2O
2Ag+H2SO4;正确答案:Ag2SO3+ H2O![]() 2Ag+H2SO4。
2Ag+H2SO4。


科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是( )
A.观察Fe(OH)2的生成
B.配制一定物质的量浓度的NaCO3溶液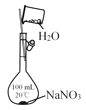
C.除去CO中的CO2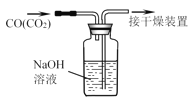
D.实验室模拟制备NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量)。(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)

回答下列问题:
(1)实验前必须先_______________________________________________。
(2)装置B的作用是_____________;装置E的作用是______________;
(3)装置D中发生氧化还原反应的化学方程式是:__________________。
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.乙醛分子的比例模型: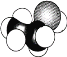
B.中子数为16的硫原子:![]() S
S
C.HCl的电子式:![]()
D.甲酸甲酯的结构简式:HCOOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如下图所示。A包含物质为H2O和___________(填化学式)
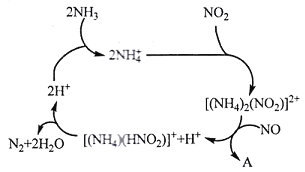
(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=___________ kJ/mol
(3)工业上利用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图甲所示。则X可以是___________(填字母序号)
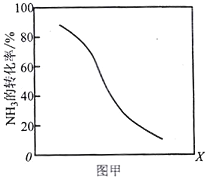
a.温度 b.压强 c.催化剂 d.![]()
②在一定温度下,向2L密闭容器中加入 n mol CH4和2 moI NH3,平衡时NH3体积分数随n变化的关系如图乙所示。
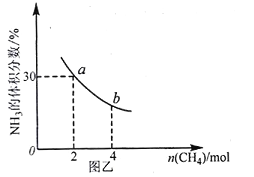
a点时,CH4的转化率为___________%;平衡常数:K(a)_____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为: Mb(ag)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为:
MbO2(aq),该反应的平衡常数可表示为:![]() 。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[
。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[![]() ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
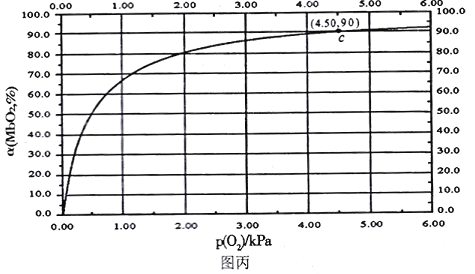
①试写出平衡常数K与速率常数k正、k逆之间的关系式为K=___________(用含有k正、k逆的式子表示)。
②试求出图丙中c点时,上述反应的平衡常数K=___________kPa-1。已知k逆=60s-1,则速率常数k正=___________s-1·kPa-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月4日凌晨,福建泉州泉港区发生“碳九”泄露,对海洋环境造成污染,危害人类健康。“碳九”芳烃主要成分包含![]() (a)、
(a)、![]() (b)、
(b)、![]() (c)等,下列有关三种上述物质说法错误的是
(c)等,下列有关三种上述物质说法错误的是
A. a、b、c互为同分异构体 B. a、b、c均能与酸性高锰酸钾溶液反应
C. a中所有碳原子处于同一平面 D. 1molb最多能与4molH2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:

①试管中加入乙醇、乙酸和浓硫酸的顺序是_______;
②浓硫酸的作用是_________;
③饱和碳酸钠溶液的主要作用____;
④装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的____,长导管的作用是________。
⑤若要把制得的乙酸乙酯分离出来,应采用的实验操作是_________。
⑥进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是______。
⑦生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号)______。
A 单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B 单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C 单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D 正反应的速率与逆反应的速率相等
E 混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李比希法常用于测定有机物的组成。如图是确定有机物化学式常用的装置,其中管式炉可提供有机物燃烧所需的高温。

(1)装置C中CuO的作用是___。
(2)装置F的作用是___。
(3)准确称取13.60g有机物(只含C、H、O三种元素中的两种或三种),经充分燃烧后,D管质量增加7.20g,E管质量增加35.20g。
①该有机物的最简式为___。
②若该有机物的相对分子质量为68,能发生银镜反应,且有2种不同化学环境的氢原子,该有机物的结构简式为___。
③若该有机物的相对分子质量为136,分子内含有一个苯环,且能与NaHCO3反应,其核磁共振氢谱有4个峰,该有机物的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入500 mL某氢氧化钠溶液中,充分反应后将溶液在低温下蒸发,得到不含结晶水的白色固体A,取三份质量不相同的A试样分别与50mL相同浓度的盐酸溶液反应,得到标准状况下气体体积与固体A的质量关系如表所示:
组别 | ① | ② | ③ |
A的质量 | 3.80 | 5.70 | 7.60 |
气体体积(mL) | 896 | 1344 | 1120 |
(1)试判断:A的成分___。
(2)盐酸物质的量浓度为___molL﹣1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com