
【题目】下列关于物质用途的说法不正确的是( )
A.二氧化硅是制作光导纤维的材料
B.氢氧化铁胶体可用作净水剂
C.碳酸氢钠可用于治疗胃酸过多
D.二氧化碳可用作镁燃烧的灭火剂
科目:高中化学 来源: 题型:
【题目】下列各组微粒的空间构型相同的是( ) ①NH3和H2O
②NH ![]() 和H3O+
和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和BeCl2
⑥NH ![]() 和SO42﹣
和SO42﹣
⑦BF3和Al2Cl6 .
A.全部
B.除④⑥⑦以外
C.③④⑤⑥
D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 T、Q、R、W 在元素周期表中的位置如图所示,其中 T 所处的周期序数与主族 族序数相等.它们的最高价氧化物水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
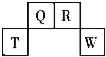
A. 甲、乙、丙、丁受热均易分解
B. 常温下丁的浓溶液可用 T 单质所制的容器来盛装
C. 丁的浓溶液与 Q 的单质加热发生反应,可生成体积比为 1:2 的两种气体
D. R 的氧化物在空气中与其它物质作用可形成光化学烟雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)下列所给出的几组物质中:含有分子数最少的是________________;标准状况下体积最小的是_____________________。
①1gH2 ②2.408×1023个CH4分子 ③10.8gH2O ④标准状况下6.72LCO2
(2)请配平方程式:___KClO3+____HCl(浓)=___KC1+____ ClO2↑+___Cl2↑+__H2O,__________
(3)溶液导电能力取决于自由移动离子的浓度和所带电荷数,离子浓度越大,所带电荷数越多,溶液导电能力越强。现有浓度均为lmol/L的以下电解质溶液:①K2CO3 ②AgNO3 ③NaHSO4 ④Al2(SO4)3⑤H2SO4 ⑥Ba(OH)2。这些溶液中导电能力最强的是__________(填序号),导电能力最弱的是____________。
(4)有12.4gNa2R含Na+为0.4mol,则Na2R的摩尔质量为____________。
(5)在0.2L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。该混合溶液中CuCl2的物质的量浓度为____________ molL-1。

(6)下图所示的警示标志,是一种____________(填选项序号)。

A.易燃品 B.剧毒品 C.腐蚀品 D.爆炸品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+ ![]() O2(g)△H=+242kJmol﹣1
O2(g)△H=+242kJmol﹣1
B.2H2(g)+O2(g)=2H2O(l)△H=﹣484kJmol﹣1
C.H2(g)+ ![]() O2(g)=H2O(g)△H=+242kJmol﹣1
O2(g)=H2O(g)△H=+242kJmol﹣1
D.2H2(g)+O2(g)=2H2O(g)△H=+484kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应I2+I﹣I ![]() 达到平衡时c(I
达到平衡时c(I ![]() )与温度的关系如图所示.下列说法正确的是( )
)与温度的关系如图所示.下列说法正确的是( ) 
A.图中反应进行到状态D时,一定有v逆>v正
B.A点和B点的化学平衡常数相同
C.对B点溶液升高温度时,该反应△v正>△v逆
D.增大KI溶液浓度有利于I2的溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,下列五种溶液:①0.1mol/LNH4Cl②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4 ④0.1mol/L NH3H2O和0.1mol/LNH4Cl混合液⑤0.1mol/LNH3H2O,请根据要求填写下列空白:
(1)溶液①呈性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是;c(NH4+)最小的是(填序号)
(3)比较溶液②、③中c(NH4+)的大小关系是②③(填“>”、“<”或“=”)
(4)在溶液④中,离子的浓度为0.1mol/L;NH3H2O和离子的物质的量浓度之和为0.2mol/L
(5)常温下,测得溶液②的pH=7,则说明CH3COO﹣的水解程度(填“>”、“<”或“=”)NH4+ 的水解程度,CH3COO﹣与NH4+浓度的大小关系是:c(CH3COO﹣)c(NH ![]() )(填“>”、“<”或“=”)
)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3 . 它的酸性类似于醋酸,可微弱电离出H+和N3﹣ . 
试回答下列问题:
(1)下列说法正确的是(选填序号).
A.酸性:HNO2>HNO3
B.N2H4中两个氮原子采用的都是sp2杂化
C.HN3、H2O都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+、Cu2+及Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4 , 在该配合物中钴显价,根据价层电子对互斥理论可知SO42﹣的立体构型为 , 写出钴原子在基态时的核外电子排布式: .
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)═2Na(l)+3N2(g),下列说法正确的是(选填序号).
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图2,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮元素的电负性小
(4)与N3﹣互为等电子体的分子有:(举两例).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com