
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)滤液1中加入H2O2溶液的目的是____________________________________________________。
(2)设计实验证明滤液1中含有Fe2+__________________________________________________________。
(3)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________________________________________________________________。
(4)由滤液2生成Ce(OH)4的离子方程式______________________________________________。
(5)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000 mol·L-1的FeSO4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为______________ (结果保留两位有效数字),Mr(Ce)=140。
【答案】使Fe2+氧化为Fe3+ 取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有Fe2+ Fe2+ +2FeO(OH) == Fe3O4 +2H+ 4Ce3 ++ O2 +12OH-+2H2O ==4Ce(OH)4↓ 0.98或98%
【解析】
反应过程为:废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)中加入稀硫酸,FeO转化为FeSO4、Fe2O3转化Fe2(SO4)3存在于滤液1中,滤渣1为CeO2和SiO2;
滤液1中加入稀硫酸和H2O2,使FeSO4氧化为Fe2(SO4)3,溶液1为Fe2(SO4)3溶液,加入硫酸铵混合蒸发浓缩、常温晾干后得到硫酸铁铵晶体;
滤渣1中加入稀硫酸和H2O2,CeO2转化为Ce3+存在于滤液2中,反应为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,滤渣2为SiO2;滤液2加入碱并通入氧气将Ce从+3氧化为+4后Ce3+转化为沉淀Ce(OH)4,反应为:4Ce3++O2+12OH-+2H2O═4Ce(OH)4↓,加入分解Ce(OH)4得到产品CeO2;据此分析作答。
(1)已知:CeO2不溶于稀硫酸,废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)中也不SiO2溶于酸,加入稀硫酸可将CeO2和SiO2与Fe2O3、FeO分离,滤液1中加入H2O2的目的是使Fe2+氧化为Fe3+;
(2)亚铁离子有还原性能使酸性高锰酸钾褪色,也与铁氰化钾生成蓝色沉淀,故证明滤液1中含有Fe2+方法为:取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有Fe2+;
(3)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,根据电子得失守恒和原子守恒可知该反应的离子方程式为Fe2+ +2FeO(OH) == Fe3O4 +2H+;
(4)滤液2为含有Ce3+的溶液,加入碱并通入氧气将Ce从+3氧化为+4后Ce3+转化为沉淀Ce(OH)4,离子方程式为:4Ce3 ++ O2 +12OH-+2H2O ==4Ce(OH)4↓;
(5)用0.1000mol/LFeSO4溶液滴定至终点,铈被还原成Ce3+,则Fe2+被氧化为Fe3+,则 Ce(OH)4~Ce3+~FeSO4, 所以n[Ce(OH)4]=n(FeSO4)=0.1×25×10-3mol,m[Ce(OH)4]=0.1×25×10-3×208g,该产品中Ce(OH)4的纯度的表达式为![]() ×100=98%。
×100=98%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体的共同点是( )
A.分散质颗粒直径都在l~100 nm之间
B.颜色都呈红褐色
C.一束平行光照射溶液时,从侧面都可以看到一束光束
D.都是分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含2mol NaOH、1mol Ba(OH)2、2mol NaAlO2的混合液中慢慢通入CO2至过量,下列有关说法正确的是

A. 整个过程中共发生四个离子反应。
B. 根据现象可判断酸性强弱为:H2CO3>HAlO2>HCO3-
C. 通入3molCO2和通入5molCO2都只产生3mol沉淀
D. 整个过程中生成沉淀的物质的量与通入CO2的体积的图象如图所示:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业尾气中的氮氧化物常用氨催化吸收法,原理是NH3和NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。
Ⅰ.提供的装置
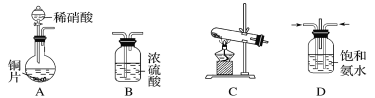
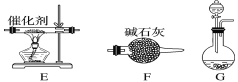
Ⅱ.NH3的制取
(1)下列有关实验室制备气体的说法正确的是________(填序号)。
①可以用排饱和食盐水的方法收集氯气 ②用赤热的炭与水蒸气反应制取氢气 ③实验室制氧气有时需要加热,有时不需要加热 ④用无水氯化钙干燥氨气 ⑤用浓盐酸洗涤高锰酸钾分解制氧气的试管
Ⅲ.模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:
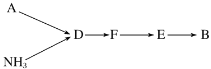
(2)A中反应的离子方程式为_______________________________。
(3)装置D的作用有:使气体混合均匀、调节气流速度,还有一个作用是___________。
(4)D装置中的液体可换成________(填字母)。
a.CuSO4 b.H2O c.CCl4 d.浓硫酸
(5)该同学所设计的模拟尾气处理实验还存在的明显缺陷_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2A(g)+ B(g)![]() 2C(g),分别测定反应在不同温度下达到平衡时B 的转化率,绘制了如图所示的曲线,图中a、b、c三点分别表示不同时刻的状态。下列分析正确的是( )
2C(g),分别测定反应在不同温度下达到平衡时B 的转化率,绘制了如图所示的曲线,图中a、b、c三点分别表示不同时刻的状态。下列分析正确的是( )

A. 该反应的△H<0
B. b点时混合气体的平均摩尔质量不再变化
C. 增大压强,可使a点达到T1温度下平衡状态
D. c点表示的状态:v (正)> v (逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是

A. 向含I的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3
D. 一定条件下,I与IO3可能生成I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在300 K时,A(g)+B(g) ![]() 2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时消耗2a mol C ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化 ⑦A、B、C的分子数之比为1∶1∶2
A. ②⑤ B. ④⑦ C. ②③ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用铁电极包解饱和食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 用强碱溶液吸收工业制取硝酸的尾气:NO+NO2+2OH-=2NO3-+H2O
C. 向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:Cu2++HS-=CuS↓+H+
D. 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3·H2O=[Al(OH)4]-+4NH4+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com