
【题目】已知某油脂A,在稀硫酸作催化剂的条件下水解,生成脂肪酸和多元醇B,B和硝酸在浓硫酸作用下通过酯化反应生成有机物D。
(1)写出油脂A在稀硫酸作催化剂的条件下水解的化学方程式:__。
(2)已知D由C、H、O、N四种元素组成,相对分子质量为227,C、H、N的质量分数分别为15.86%、2.20%和18.50%,则D的分子式是__,B→D的化学方程式是__。
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式:__。
【答案】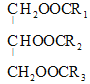 +3H2O
+3H2O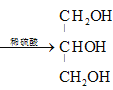 +R1COOH+R2COOH+R3COOH(R1、R2、R3用R表示也可以) C3H5O9N3
+R1COOH+R2COOH+R3COOH(R1、R2、R3用R表示也可以) C3H5O9N3 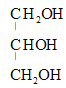 +3HNO3
+3HNO3 +3H2O CH3COOCH2CH(OH)CH2OH、HOCH2CH(OOCCH3)CH2OH
+3H2O CH3COOCH2CH(OH)CH2OH、HOCH2CH(OOCCH3)CH2OH
【解析】
(1)油脂是高级脂肪酸甘油酯,在稀硫酸作催化剂的条件下水解为高级脂肪酸和甘油,水解化学方程式是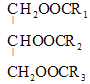 +3H2O
+3H2O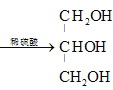 +R1COOH+R2COOH+R3COOH(R1、R2、R3用R表示也可以);
+R1COOH+R2COOH+R3COOH(R1、R2、R3用R表示也可以);
(2)D相对分子质量为227,C原子数是![]() 、H原子数是
、H原子数是![]() 、N原子数是
、N原子数是![]() ,O原子数是
,O原子数是![]() ,则D的分子式是
,则D的分子式是![]() ,甘油和硝酸在浓硫酸作用下通过酯化反应生成有机物
,甘油和硝酸在浓硫酸作用下通过酯化反应生成有机物![]() 和水,反应的化学方程式是
和水,反应的化学方程式是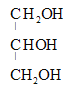 +3HNO3
+3HNO3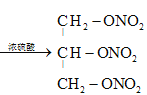 +3H2O;
+3H2O;
(3)C是B(丙三醇,相对分子质量为92)和乙酸反应的产物,且相对分子质量为134,推测C是B和乙酸按物质的量之比为1∶1反应所得的产物,其可能结构有以下两种: 和
和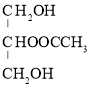 。
。


科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下所示。下列说法错误的是

A.甲位于现行元素周期表第四周期第ⅢA族
B.原子半径比较:甲>乙>Si
C.原子序数:甲-Ca=1
D.推测乙的单质可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知单质硫16 g燃烧放热为149 kJ,写出硫燃烧热的热化学方程式:_________________
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知: C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol③
根据盖斯定律,计算298 K时由C(石墨,s)和H2(g)生成1 mol C2H2(g)反应的焓变:_____________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ/mol、497 kJ/mol。 N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol,NO分子中化学键的键能为_____ kJ/mol。
(4)S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ/mol;
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ/mol;
③S(单斜,s)=S(正交,s) ΔH3=_____。
S(单斜,s)比S(正交,s)更_________(填“稳定”或“不稳定”)
(5)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1 、ΔH2,则ΔH1___________ΔH2。(用“>”、“<”或“=”填空)
(6)相同条件下,2 mol氢原子所具有的能量________1 mol 氢分子所具有的能量。(用“>”、“<”或“=”填空)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A.pH=a的氨水,稀释10倍后,其pH=b,则a<b+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl溶液恰好无色,则此时溶液的pH<7
C.向10mL0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
D.向10mLpH=11的氨水中加入10mLpH=3的H2SO4溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸罗替戈汀是一种用于治疗帕金森病的药物,其合成路线流程图如下:
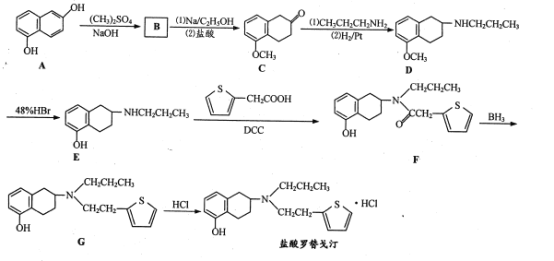
(1)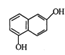 、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
(2)D→E的反应类型是_______。
(3)B的分子式为C12H12O2,写出B的结构简式;____ 。
(4)C的一种同分异构体X同时满足下列条件,写出X的结构简式:_______。
①含有苯环,能使溴水褪色;
②能在酸性条件下发生水解,水解产物分子中所含碳原子数之比为6:5,其中一种水解产物分子中含有3种不同化学环境的氢原子。
(5)已知:![]()
![]() R3COOH+
R3COOH+![]() ,写出以
,写出以![]() 和
和![]() 为原料制备
为原料制备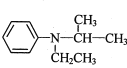 的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol/L的HR溶液中逐滴滴入0.l mol/L 的氨水,溶液pH及导电性变化如图。
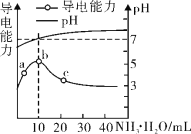
下列分析正确的是
A.HR为强酸
B.加入10 mL 氨水时,溶液中c(NH4+)>c(R-)
C.c点溶液存在c(NH4+)<c( R-)
D.b点的离子浓度大于a点的离子浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种激光染料常应用于可调谐激光器,该物质由C、H、O三种元素组成,分子球棍模型如图所示,下列有关其叙述正确的有( )
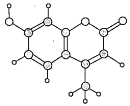
①分子式为C10H9O3 ②能与溴水发生取代反应
③能与溴水发生加成反应 ④能使KMnO4酸性溶液褪色
⑤1mol该物质最多能与2molNaOH反应
A.①②③B.①③④⑤C.②③④D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]比FeSO4稳定,不易被氧气氧化,常用于代替FeSO4作分析试剂。某小组尝试制备少量(NH4)2Fe(SO4)2·6H2O并探究其分解产物。

I.制备硫酸亚铁铵晶体的流程如下:
(1)铁屑溶于稀硫酸的过程中,适当加热的目的是_________。
(2)将滤液转移到_________中,迅速加入饱和硫酸铵溶液,直接加热蒸发混合溶液,观察到_________停止加热。蒸发过程保持溶液呈较强酸性的原因是_________。
Ⅱ.查阅资料可知,硫酸亚铁铵晶体受热主要发生反应:
____(NH4)2Fe(SO4)2·6H2O=____Fe2O3+____SO2↑+____NH3↑+____N2↑+____H2O
但伴有副反应发生,生成少量SO3和O2。设计以下实验探究部分分解产物:
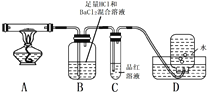
(3)配平上述分解反应的方程式。
(4)加热过程,A中固体逐渐变为_______色。
(5)B中迅速产生少量白色沉淀,反应的离子方程式为______。
(6)C的作用是_________。
(7)D中集气瓶能收集到O2,____ (填“能”或“不能”)用带火星木条检验。
(8)上述反应结来后,继续证明分解产物中含有NH3的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,利用合成气(CO、H2、CO2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol K1
CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol K1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.77 kJ/mol K2
CH3OH(g) ΔH2=-90.77 kJ/mol K2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3 K3
CO(g)+H2O(g) ΔH3 K3
(1)反应③的ΔH3=________,化学平衡常数K3与K1、K2的代数关系是K3=_____。
(2)要使反应②的速率和转化率都增大,需要改变的条件是___________。在5MPa下,要提高反应②的转化率,可采取的措施有__________、_________(答两条)。
(3)若反应①在恒容密闭容器中进行,下列可以判断该反应达到平衡的是_______(填标号)。
A.v正(H2)=v逆(CH3OH) B.混合气压强不变
C.c(H2)与c(H2O)比值不变 D.混合气密度不变
(4)在一定温度和催化剂存在下,向1L密闭容器中充入1molCO2和3molH2发生反应①。当CO2的平衡转化率为50%时,产物甲醇的体积分数为________,该温度下,正反应的平衡常数K=__________。若向容器中再充入0.5molH2和0.5molH2O(g),其他条件不变时平衡_______移动(填“正向”“逆向”“不”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com