
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 .
. .
. .
. .
. .
.分析 短周期元素中,F原子中无中子,则F为氢元素;G最高正价数与负价数相等,且最外层电子数是次外层的二倍,原子只能有2个电子层,最外层电子数为4,故G为碳元素;H元素单质焰色反应呈黄色,则H为Na;C、E均有-2价,处于ⅣA族,且C的原子半径较大,故C为S元素、E为O元素;D有-1价,原子半径大于O,故D为Cl元素;A有+2价、B有+3价,原子半径均大于S,可推知A为Mg、B为Al,据此解答.
解答 解:短周期元素中,F原子中无中子,则F为氢元素;G最高正价数与负价数相等,且最外层电子数是次外层的二倍,原子只能有2个电子层,最外层电子数为4,故G为碳元素;H元素单质焰色反应呈黄色,则H为Na;C、E均有-2价,处于ⅣA族,且C的原子半径较大,故C为S元素、E为O元素;D有-1价,原子半径大于O,故D为Cl元素;A有+2价、B有+3价,原子半径均大于S,可推知A为Mg、B为Al.
(1)B为Al元素,在元素周期表中的位置为:第三周期ⅢA族,B形成的简单离子的结构示意图为  ,故答案为:第三周期ⅢA族;
,故答案为:第三周期ⅢA族; ;
;
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是:HClO4,故答案为:HClO4;
(3)C、H形成化合物为Na2S,用电子式表示其形成过程: ,
,
G、E形成最高价化合物为CO2,用电子式表示形成过程: ,
,
故答案为: ;
; ;
;
(4)H、E形成原子个数比为1:1的化合物为Na2O2,含有离子键、共价键,
F、E形成原子个数比为1:1的化合物为H2O2,电子式为 ,
,
故答案为:离子键、共价键; ;
;
(5)F与G形成的10单质化合物为CH4,电子式为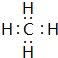 ,该分子的结构式为
,该分子的结构式为 ,
,
故答案为: ;
;
(6)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->O2->Mg2+>Al3+,
故答案为:S2->O2->Mg2+>Al3+.
点评 本题考查位置结构性质的关系及应用,根据化合价与原子半径推断元素是解题的关键,侧重对化学用语的考查,注意掌握用电子式表示物质或化学键的形成.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
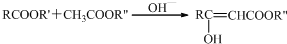
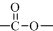 结构;
结构;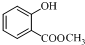 +(CH3CO)2O$\stackrel{H+}{→}$
+(CH3CO)2O$\stackrel{H+}{→}$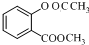 +CH3COOH.
+CH3COOH.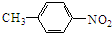 .
. $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$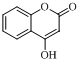 +CH3OH.
+CH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A | B | C | D | |
| X | HCl | BaCl2 | Na2CO3 | Al2(SO4)3 |
| Y | NaAlO2 | H2SO4 | H2SO4 | NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
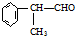 的物质,该物质是一种香料.
的物质,该物质是一种香料.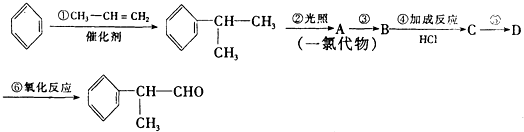
 .
. +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2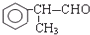 +2H2O.
+2H2O.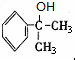 生成
生成 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应 | |
| B. | 氧化物中都含有氧元素,则含有氧元素的化合物一定是氧化物 | |
| C. | 碱溶液的pH>7,则pH>7的溶液一定是碱的溶液 | |
| D. | 点燃H2和O2的混合气体可能发生爆炸,则H2点燃前须检验纯度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 说法 | 解释 |
| A | 氯化镁 | 用惰性电极电解MgCl2溶液可冶炼Mg | Mg2+在阴极得电子生成Mg |
| B | 氧化铝 | 制作耐高温材料 | Al2O3熔点很高 |
| C | 硫酸钡 | 医学上用做钡餐 | Ba2+无毒 |
| D | 明矾 | 作消毒剂 | 明矾水解产生具有吸附性的胶体粒子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
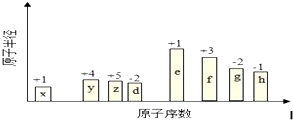
 .
.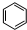 +HNO3$→_{50-60℃}^{浓硫酸}$
+HNO3$→_{50-60℃}^{浓硫酸}$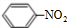 +H2O,反应类型取代反应.
+H2O,反应类型取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com