
| A. | A、B均为气体,平衡逆向移动 | B. | A为气体,平衡正向移动 | ||
| C. | B为气体,平衡不移动 | D. | A、B都不是气体,平衡正向移动 |
分析 保持温度不变,将容器的体积扩大1.5L后,如平衡不移动,C的浓度为$\frac{1}{1.5}$mol/L=$\frac{2}{3}$mol/L,小于实际C的浓度变为0.75mol/L,说明平衡向生成C的方向移动,即向正反应移动,据此结合选项解答.
解答 解:保持温度不变,将容器的体积扩大1.5L后,如平衡不移动,C的浓度为$\frac{1}{1.5}$mol/L=$\frac{2}{3}$mol/L,小于实际C的浓度变为0.75mol/L,说明平衡向生成C的方向移动,即向正反应移动,
A、增大体积,压强减小,平衡向向正反应移动即气体体积增大的方向,所以B为非气体,故A错误;
B、增大体积,压强减小,平衡向向正反应移动即气体体积增大的方向,所以A为气体,B为非气体,故B正确;
C、增大体积,压强减小,平衡向向正反应移动即气体体积增大的方向,所以B为非气体,故C错误;
D、增大体积,压强减小,平衡向向正反应移动即气体体积增大的方向,所以A、B可以都不是气体,故D正确;
故选:BD.
点评 本题考查化学平衡移动,难度中等,利用假设法判断平衡移动方向是解题关键.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:解答题
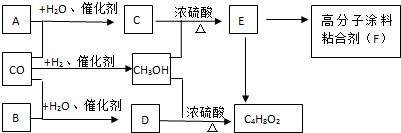
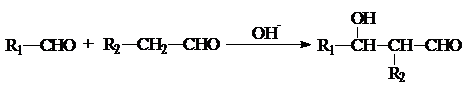 .有机物G(C20H18O4)是一种酯,合成路线如下:
.有机物G(C20H18O4)是一种酯,合成路线如下:
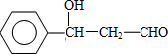 ,F 的结构简式是CH2OHCH2OH;
,F 的结构简式是CH2OHCH2OH;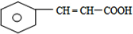 +CH2OHCH2OH$→_{△}^{浓硫酸}$
+CH2OHCH2OH$→_{△}^{浓硫酸}$ +2H2O;
+2H2O;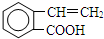
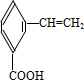 、
、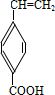 、
、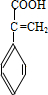 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:
A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:| 元素 | 相关信息 |
| A | 元素A是周期表中原子半径最小的元素 |
| B | B的单质由双原子分子构成,分子中有14个电子 |
| C | C3单质在大气层的平流层中,其浓度的减少会导致人患皮肤癌 |
| D | D是前四周期元素中第一电离能最小的元素 |
| E | E位于ds区且原子的最外层电子数与A相同 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯(溴水) | B. | 乙烷中的乙烯(氢气) | ||
| C. | 溴苯中的溴(碘化钾溶液) | D. | 乙醇中的水(新制的CaO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | a中试剂 | b中试剂 | 实验现象 | 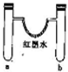 |
| A | 1mL12mol•L-1浓盐酸0.5gMnO2 | 0.1gCaCO3、1mL 2mol•L-1盐酸 | 红墨水褪色,U形管中液面左右基本持平 | |
| B | 0.1gNa3mol水 | 0.1gNa 3mol乙醇 | 反应开始阶段,反应结束静置一段时间后U形管中液面都是左低右高 | |
| C | 3mL浓硫酸、铁钉 | 3mLNaCl溶液、铁钉 | 铁钉均生锈,U形管中液面左高右低 | |
| D | 3mL水 | 3mL饱和FeSO4溶液 | 一段时间后,U形管中液面左低右高,b管溶液中出现红褐色浑浊物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验目的 | 实验设计 |
| A | 证明CH2═CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| B | 鉴别碳酸钠溶液与碳酸氢钠溶液 | 分别加入少量的氢氧化钠溶液,观察现象 |
| C | 实验室制取少量O2气体 | 将蒸馏水滴入过氧化钠固体中,用排水法收集产生的气体 |
| D | 除去硫酸铜溶液中少量的硫酸铁 | 加入过量铜粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铯碱性强于氢氧化钠 | |
| B. | 碱金属单质从Li到Cs,熔点依次升高 | |
| C. | 碱金属单质均为银白色,从Li到Cs,密度逐渐增大 | |
| D. | 碱金属元素形成的阳离子,从Li+到Cs+,氧化性依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com