
【题目】回答下列问题:(1)下列物质中 ①Cu ②液态SO2 ③CH3COOH ④NaHCO3 ⑤Ba(OH)2溶液 ⑥熔融NaCl ⑦稀氨水 ⑧BaSO4 ⑨H2O。属于强电解质的是_________(填序号),属于弱电解质的是 ________(填序号);
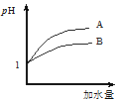
(2)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是________;
(3)现有25℃、pH=13的Ba(OH)2溶液,与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=__________.
【答案】 ④⑥⑧ ③⑨ A 2
【解析】(1)①Cu 是单质既不是电解质也不是非电解质;②液态SO2属于非金属氧化物,是非电解质;③CH3COOH是弱酸,在水溶液中或熔融状态下能部分电离,为弱电解质;④NaHCO3 属于盐,在水溶液中或熔融状态下能完全电离,为强电解质;⑤Ba(OH)2溶液属于混合物,既不是电解质也不是非电解质;⑥熔融NaCl属于盐,在水溶液中或熔融状态下能完全电离,为强电解质;⑦稀氨水属于混合物,既不是电解质也不是非电解质;⑧BaSO4 属于盐,在水溶液中或熔融状态下能完全电离,为强电解质;⑨H2O能够部分电离产生自由移动的离子,属于弱电解质;属于强电解质的是:④⑥⑧;属于弱电解质的是:③⑨;故答案为:④⑥⑧;③⑨;
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,导致稀释相同的倍数时,醋酸溶液的酸性比盐酸强,醋酸的pH小于HCl,根据图象知,A是HCl变化曲线,故选A;
(3)设盐酸的物质的量浓度为:c(HCl),碱与酸体积分别为1L、9L,则n(OH -)=0.1mol/L×1L=0.1mol,n(H+)=c(HCl)×9L,反应后剩余氢氧根离子的物质的量为:0.1mol-c(HCl)×9L;由混合所得溶液pH=11可知,混合后c(H+)=10-11 molL-1,则混合后c(OH -)=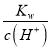 =10-3 molL-1,所以
=10-3 molL-1,所以![]() =10-3 molL-1,解得:c(HCl)=10-2molL-1,pH=-lg c(H+),所以pH=2,故答案为:2。
=10-3 molL-1,解得:c(HCl)=10-2molL-1,pH=-lg c(H+),所以pH=2,故答案为:2。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( ) 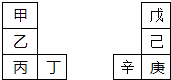
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水溶液中有不同的性质。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有_____________。
a.溶液中氢氧离子浓度 b.氨水的电离程度c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________________(填“相同”或“不相同”),其原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W,X,Y,Z的原子序数依次增大,W,X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.多糖、油脂、蛋白质均为高分子化合物
B.淀粉和纤维素水解的最终产物均为葡萄糖
C.可用酸性 KMnO4 溶液鉴别苯和环己烷
D.分离溴苯和苯的混合物:加入 NaOH 溶液分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I﹣、Br﹣的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b﹣a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )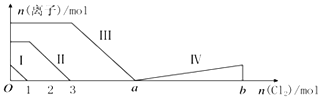
A.线段Ⅱ表示Br﹣的变化情况
B.线段Ⅳ表示IO3﹣的变化情况,其中IO3﹣增加了5moL.
C.a=6
D.原溶液中n(FeI2):n(FeBr2)=3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 .
请回答下列问题:
(1)图中A、C分别表示、 , E的大小对该反应的反应热有无影响? . 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是;
(2)图中△H=kJmol﹣1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式;
(4)如果反应速率υ(SO2)为0.05molL﹣1min﹣1 , 则υ(O2)=molL﹣1min﹣1、υ(SO3)=molL﹣1min﹣1;
(5)已知单质硫的燃烧热为296kJmol﹣1 , 计算由S(s)生成3molSO3(g)的△H(要求计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.实验室用加热NH4Cl固体的方法制备NH3
B.用点燃的火柴在液化气钢瓶口检验是否漏气
C.工业上用SO2漂白纸浆、毛、丝、草帽辫等
D.保存金属钠的仓库着火可以用二氧化碳灭火器去灭火
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com