
【题目】下列关于浓硫酸的说法正确的是
A.易挥发B.有脱水性C.无吸水性D.密度比水小
科目:高中化学 来源: 题型:
【题目】I.铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作___________剂。
(2)自然界的Cr主要以+3价和+6价(Cr2O72-)存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为Cr3+。写出该离子方程式:_________________________________。
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是____________________________________。
II.(NH4)2Fe(SO4)2·6H2O(莫尔盐,浅绿色)用作化学试剂、医药以及用于冶金、电镀等。某课题组通过实验检验莫尔盐晶体加热时的分解产物,回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_________________________。
(2)①甲同学提出猜想:分解产物可能是N2、Fe2O3、SO3、H2O四种物质。你是否同意并说明理由:_________________________________________。
②乙同学设计了如图装置,其中装置中的固体变为红棕色,则固体产物中含有___________;
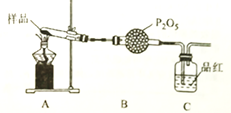
C装置中红色褪去,说明气体产物中含有_______;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是__________________(写一种即可)。
③丙同学想利用上述装罝证明分解产物中含有氨气,只需要更换B和C中的试剂即可,则更换后的试剂为B________________,C_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g) ![]() CH3OH(g),现在实验室模拟该反应并进行分析。
CH3OH(g),现在实验室模拟该反应并进行分析。
(1) 下图是该反应在不同温度下CO的转化率随时间变化的曲线。

① 该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
② T1和T2温度下的平衡常数大小关系是K1_______K2(填 “>”、“<”或“=”)。
③ 若容器容积不变,下列措施可增加甲醇产率的是______________。
A. 升高温度 B. 将CH3OH(g)从体系中分离
C. 使用合适的催化剂 D. 充入He,使体系总压强增大
(2)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示

下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小 ③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(3)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.同温同压下,相同体积的气体,其气体分子物质的量也相等
B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数可能不相等
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.同温同压下,若体积不相等,则一氧化碳气体和氮气质量可能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5时,发生以下两个分解反应:N2O5![]() N2O3+O2,N2O3
N2O3+O2,N2O3![]() N2O+O2,在1 L密闭容器中加热4 mol N2O5达到化学平衡时c(O2)为4.50 mol/L,c(N2O3)为1.62 mol/L,则在该温度下各物质的平衡浓度正确的是
N2O+O2,在1 L密闭容器中加热4 mol N2O5达到化学平衡时c(O2)为4.50 mol/L,c(N2O3)为1.62 mol/L,则在该温度下各物质的平衡浓度正确的是
A. c(N2O5)=1.44 mol/L B. c(N2O5)=0.94 mol/L
C. c(N2O)=1.40 mol/L D. c(N2O)=3.48 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g) + yB(g)![]() zC(g)平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是 ( )
zC(g)平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是 ( )
A. x + y < z B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,下列各组离子能大量共存的是( )
A.K+、Fe3+、SO ![]() 、NO3﹣
、NO3﹣
B.Cu2+、Mg2+、SO ![]() 、Cl﹣
、Cl﹣
C.Ag+、Na+、NO3﹣、Cl﹣
D.K+、Na+、CO ![]() 、OH﹣
、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是
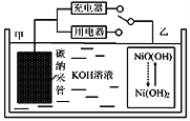
A. 放电时,乙电极反应为:Ni(OH)2+OH- e=NiO(OH)+H2O
B. 放电时,甲电极为正极,OH移向乙电极
C. 电池总反应为H2+2NiO(OH) ![]() 2Ni(OH)2
2Ni(OH)2
D. 充电时,电池的碳电极与直流电源的正极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com