
| A. | 11.2 L | B. | 22.4 L | C. | 33.6 L | D. | 44.8 L |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
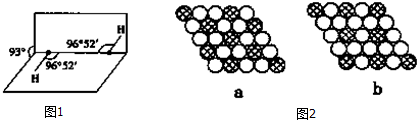
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g苯含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA | |
| C. | 1.6 g CH4含有共用电子对的数目为0.5NA | |
| D. | 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
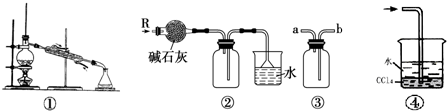
| A. | 装置①可用于由工业酒精制取无水酒精 | |
| B. | 装置②可用于干燥、收集氨气,并吸收多余的氨气 | |
| C. | 装置③可用于排空气法收集NO气体 | |
| D. | 装置④中下层物质若为四氯化碳,则可用于吸收氯化氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com