
(9分)25℃时,有0.01 mol•L-1的醋酸溶液,试回答下列问题:
(1)写出醋酸的电离平衡常数表达式
(2)达平衡时,溶液中氢离子浓度是多少?(25℃时,醋酸的电离平衡常数为1. 75×10 -5)
(3)当向该溶液中加入一定量的盐酸时,溶液中的c(H+)、c (CH3COO-)、c (CH3COOH) 是否又发生变化? 电离常数是否发生变化? 为什么 ?
(1)K=  (2)4.18×10 -4 mol•L-1
(2)4.18×10 -4 mol•L-1
(3)c(H+)增大 c (CH3COO-)减小 c (CH3COOH)增大 电离常数不变,因为电离常数只受温度影响,温度不变,电离常数不变
【解析】(1)电离平衡常数和化学平衡常数是类似的,所以醋酸的电离平衡常数表达式为K=  。
。
(2)醋酸的电离方程式为CH3COOH CH3COO-+H+,即溶液中氢离子浓度和CH3COO-的浓度是相同的。又因为醋酸的电离程度很弱,所以溶液中醋酸的浓度近似是0.01mol/L,所以氢离子的浓度
CH3COO-+H+,即溶液中氢离子浓度和CH3COO-的浓度是相同的。又因为醋酸的电离程度很弱,所以溶液中醋酸的浓度近似是0.01mol/L,所以氢离子的浓度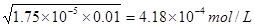 。
。
(3)电离常数和温度,所以是不变的。加入盐酸,增大氢离子的浓度,抑制醋酸的电离,所以c (CH3COO-)减小,c (CH3COOH)增大。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2011-2012学年海南省洋浦中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(9分)25℃时,有0.01 mol?L-1的醋酸溶液,试回答下列问题:
(1)写出醋酸的电离平衡常数表达式
(2)达平衡时,溶液中氢离子浓度是多少?(25℃时,醋酸的电离平衡常数为1. 75×10 -5)
(3)当向该溶液中加入一定量的盐酸时,溶液中的c(H+)、c (CH3COO-)、c (CH3COOH) 是否又发生变化? 电离常数是否发生变化? 为什么 ?
查看答案和解析>>
科目:高中化学 来源:2012届海南省高二上学期期末考试化学试卷 题型:计算题
25℃时,有0.01 mol·L-1的醋酸溶液,试回答下列问题:
(1)写出醋酸的电离平衡常数表达式
(2)达平衡时,溶液中氢离子浓度是多少?(25℃时,醋酸的电离平衡常数为1. 75×10 -5)
(3)当向该溶液中加入一定量的盐酸时,溶液中的c(H+)、c (CH3COO-)、c (CH3COOH) 是
否又生变化? 电离常数是否发生变化? 为什么 ?
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,有0.01 mol•L-1的醋酸溶液,试回答下列问题:
(1)写出醋酸的电离平衡常数表达式
(2)达平衡时,溶液中氢离子浓度是多少?(25℃时,醋酸的电离平衡常数为1. 75×10 -5)
(3)当向该溶液中加入一定量的盐酸时,溶液中的c(H+)、c (CH3COO-)、c (CH3COOH) 是否又生变化? 电离常数是否发生变化? 为什么 ?
查看答案和解析>>
科目:高中化学 来源:河北省冀州中学2012届高二上学期第二次月考(化学)doc 题型:填空题
(6分)25℃时,有0.01 mol•L-1的醋酸溶液,(1)醋酸的电离平衡常数表达式
达平衡时,溶液中氢离子浓度是 (25℃时,醋酸的电离平衡常数为1. 75×10 -5)
当向该溶液中加入一定量的盐酸时,电离常数 发生变化(填是否)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com