
| 物质类别 | 酸 | 碱 | 盐 | 金属氧化物 | 非金属氧化物 |
| 化学式 | ①HCl ②H2SO4、H2CO3、H2SO3、H2S | ③NaOH、KOH ④Ba(OH)2 | ⑤Na2SO4 ⑥Na2CO3、Na2SO4、Na2SO3、Na2S | ⑦Na2O | ⑧CO2 ⑨H2O2 |
分析 (1)根据物质的分类和酸碱盐以及氧化物的概念进行分类,含氧酸含有氧元素并能电离出氢离子;碱电离出的阴离子全部为氢氧根离子;盐电离出得阳离子为金属离子,阴离子为酸根离子;氢化物为非金属元素与氢元素组成的化合物.C、S为非金属元素,对应的含氧酸有H2SO4、H2SO3或H2CO3 ,K、Na为活泼金属元素,对应的碱有NaOH和KOH,形成的盐为含氧酸盐,有Na2SO4、K2SO3或K2SO4或Na2CO3、K2CO3、Na2SO3等,无氧酸盐Na2S,氢化物有CH4、H2S;
(2)双氧水在二氧化锰的催化作用下分解可以制得氧气;
(3)④Ba(OH)2和⑤Na2SO4反应生成硫酸钡沉淀和氢氧化钠,反应为复分解反应.
解答 解:(1)根据物质的分类和酸碱盐以及氧化物的概念进行分类,含氧酸含有氧元素并能电离出氢离子;碱电离出的阴离子全部为氢氧根离子;盐电离出得阳离子为金属离子,阴离子为酸根离子;氢化物为非金属元素与氢元素组成的化合物.C、S为非金属元素,对应的含氧酸有H2SO4、H2SO3或H2CO3 ,K、Na为活泼金属元素,对应的碱有NaOH和KOH,形成的盐为含氧酸盐,有Na2SO4、K2SO3或K2SO4或Na2CO3、K2CO3、Na2SO3等,无氧酸盐Na2S,氢化物有CH4、H2S,图表中填写的物质化学式分别为:
②H2SO4、H2CO3、H2SO3、H2S
③NaOH、KOH
⑥Na2CO3、Na2SO4、Na2SO3、Na2S
故答案为:H2SO4、H2CO3、H2SO3、H2S;NaOH、KOH;Na2CO3、Na2SO4、Na2SO3、Na2S;
(2)实验室由⑨H2O2制备O2的反应为过氧化氢在二氧化锰催化剂作用下分解生成水和氧气,反应的化学方程式:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
(3)④Ba(OH)2和⑤Na2SO4反应生成硫酸钡沉淀和氢氧化钠,反应的化学方程式为:Ba(OH)2+Na2SO4=BaSO4↓+2NaOH,反应为复分解反应,
故答案为:Ba(OH)2+Na2SO4=BaSO4↓+2NaOH;复分解.
点评 本题考查物质的分类,物质组成和概念实质的理解应用,题目难度不大,注意把握相关概念.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:推断题

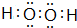 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
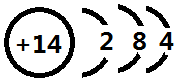 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
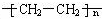 ,属于加聚反应.
,属于加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2 | B. | NO2 | C. | PM2.5 | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com