
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温条件下,11.2L甲烷气体含甲烷分子数为0.5NA
B.标准状况下,22.4L Cl2通入水中,反应过程中转移电子数为NA
C.常温条件下,0.1mol·L-1的氢氧化钠溶液中含钠离子数为0.1NA
D.标准状况下,16g O2和O3的混合气体中含氧原子数为NA
D
【解析】
试题分析:A、常温条件下,11.2L甲烷气体的物质的量不是0.5mol,则分子含甲烷分子数不是0.5NA,A错误;B、标准状况下,22.4L Cl2的物质的量是1mol,通入水中生成次氯酸和盐酸,但该反应是可逆反应,因此反应过程中转移电子数小于NA,B错误;C、常温条件下,不能确定0.1mol·L-1的氢氧化钠溶液的体积,则其中含钠离子数不一定为0.1NA,C错误;D、氧气和臭氧都是由氧原子形成的不同单质,所以标准状况下,16g O2和O3的混合气体中氧原子的物质的量是16g÷16g/mol=1mol,因此含氧原子数为NA,D正确,答案选D。
考点:考查阿伏伽德罗常数的计算


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源:2014-2015学年广东省等七校高三12月联考理综化学试卷(解析版) 题型:选择题
下列叙述I和II均正确并有因果关系的是
选项 | 叙述I | 叙述II |
A | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
B | 盐酸的酸性强于氢硫酸 | 氯元素比硫元素非金属性强 |
C | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
D | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol?L-1的Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下:

(1)反应Ⅰ发生反应的化学方程式是 ;
反应Ⅱ发生反应的离子方程式是 ;
(2)操作Ⅲ的实验步骤为 、 ;可循环利用的物质的化学式为 ;
(3)计算用2.5kg含MnO280%的软锰矿制备,理论上可得KMnO4为 :
(4)取制得的产品6.5g,配成250mL溶液;准确称取纯Na2C2O41.34g配成适量溶液。用上述KMnO4溶液滴定Na2C2O4溶液,恰好反应(氧化产物为CO2,还原产物为Mn2+)时,消耗KMnO4溶液的体积为25.00mL。该KMnO4的纯度为 %(保留小树点后一位)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:填空题
(7分)工业尾气SO2、NO2是污染大气、形成酸雨的罪魁祸首。请回答下列问题:
(1)用CO可以消除SO2污染。已知一定条件下,2CO(g)+O2(g)==2CO2(g)的能量变化如图所示,由固体S单质生成l molSO2(g)的焓变为 296kJ·mol
296kJ·mol 。
。
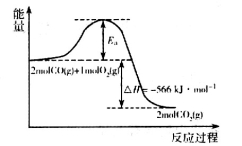
在相同条件下,CO与SO2反应生成单质S与CO2的热化学方程式为___________________________。
(2)异氰酸(化学式:HNCO,C为+4价)可用于消除尾气中的NO2。其反应原理为:
HNCO+NO2→N2+CO2+ (未配平)。
(未配平)。
①上述反应的氧化剂是____________。
②配平后方框内应填写____________。
③每处理33.6LNO2(标准状况),反应中转移电子的物质的量为____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列关于元素周期表和元素周期律的说法正确的是
A.ⅥA族元素的原子半径越大,越容易得到电子
B.I A族与VIIA族元素间能形成离子化合物也能形成共价化合物
C.I A族元素的金属性比ⅡA族元素的金属性强
D.原子最外层电子数为2的元素一定位于元素周期表中的ⅡA族
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:填空题
(16分)采用32%~35%的FeCl3溶液腐蚀印刷线路板上的金属铜,腐蚀废液中主要含有CuCl2、FeCl2和HCl等溶质。
(1)用FeCl3溶液溶解印刷线路板上金属铜的化学方程式为 。
(2)工业上用铁粉回收腐蚀废液中的铜,方法如下:
①用铁粉回收铜的操作为:加入过量铁粉,充分搅拌,过滤、洗涤、 。
②科学家对铁置换铜的工艺有如下研究:
分别在a、b、c三种条件下回收腐蚀废液中的铜,取充分反应后的粉末各3.000 g分别放入甲、乙、丙三个烧杯中,再加入100 mL 0.5 mol·L-1的硫酸,水浴加热(70 ℃),搅拌,进行除铁处理。分别在第10、20、30、40、50 min时,用吸管移取0.5 g左右的铜试样于试管内,测定铜粉中铁的含量(质量分数),其结果如下图所示。
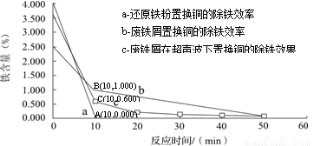
你认为除铁效果最好的是 (填“a”、“b”或“c”),其原因是 。
(3)工业上可用腐蚀废液制备CuCl2·2H2O,从而进行对废液的利用,其工艺流程如下:
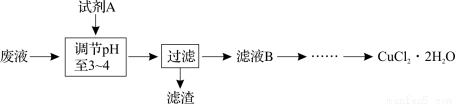
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀 | 2.3 | 7.5 | 4.7 |
完全沉淀 | 4.1 | 9.7 | 6.7 |
试剂A最好应选用 (填写字母代号),理由是 。
a.浓硫酸 b.Cl2 c.NaClO d.NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:填空题
(12分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程脱硫实现了 (选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)过滤操作用到的玻璃仪器有: 。
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是 。
(4)写出KMnO4溶液加入到MnSO4溶液中制备MnO2的离子反应方程式: ;用惰性电极电解MnSO4溶液也可制得MnO2,其阳极的电极反应式是 。
(5)MnO2是碱性锌锰电池的电极材料,电池反应方程式为:2MnO2+Zn+H2O====2MnOOH+Zn(OH)2,写出该电池放电时,正极的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
碳纳米管是由碳原子组成的六角形蜂巢状平面薄膜卷曲而成,具有许多异常的力学、电学和化学性能。

下列关于碳纳米管的说法不正确的是
A.碳纳米管属于一种有机合成纤维
B.碳纳米管与金刚石互为同素异形体
C.常温下,碳纳米管具有较好的稳定性
D.碳纳米管比表面积大,可用作新型储氢材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com