
| A. | △H1>△H2 | |
| B. | 设计反应①的主要目的是增大n(CO)/n(H2)的比值 | |
| C. | CO(g)+H2O(g)?CO2(g)+H2(g)的正反应为吸热反应 | |
| D. | △H2=4△H1=659.3 KJ•mol-1 |
分析 A.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2,此反应为甲烷完全燃烧时的反应,CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1,此反应为甲烷不完全燃烧时的反应,则完全燃烧放出的热量大于不完全燃烧,放热为负值,故△H1>△H2,据此进行分析;
B.主反应:CO(g)+2H2(g)═CH3OH(g)△H4=90.0KJ•mol-1,故主反应n(CO)/n(H2)=$\frac{1}{2}$,而反应①中n(CO)/n(H2)的比值也为$\frac{1}{2}$,故没起到反应增大n(CO)/n(H2)的比值的作用;
C.④主反应:CO(g)+2H2(g)═CH3OH(g)△H4=90.0KJ•mol-1
⑤副反应:CO2(g)+3H2(g)═CH3OH(g)+HzO(g)△H5=49.0KJ•mol-1,④-⑤得,CO(g)+H2O(g)?CO2(g)+H2(g)△H=41.0KJ•mol-1,△H>0,故正反应为吸热反应,据此进行分析;
D.①主反应;CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1,①×4得,4CH4(g)+2O2(g)═4CO(g)+8H2(g)△H=4△H1,②副反应:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2,这与反应②热化学方程式不一样,故△H2≠4△H1.
解答 解:A.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2,此反应为甲烷完全燃烧时的反应,CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1,此反应为甲烷不完全燃烧时的反应,则完全燃烧放出的热量大于不完全燃烧,放热为负值,故△H1>△H2,故A正确;
B.主反应:CO(g)+2H2(g)═CH3OH(g)△H4=90.0KJ•mol-1,故主反应n(CO)/n(H2)=$\frac{1}{2}$,而反应①中n(CO)/n(H2)的比值也为$\frac{1}{2}$,故没起到反应增大n(CO)/n(H2)的比值的作用,故B错误;
C.④主反应:CO(g)+2H2(g)═CH3OH(g)△H4=90.0KJ•mol-1
⑤副反应:CO2(g)+3H2(g)═CH3OH(g)+HzO(g)△H5=49.0KJ•mol-1,④-⑤得,CO(g)+H2O(g)?CO2(g)+H2(g)△H=41.0KJ•mol-1,△H>0,故正反应为吸热反应,故C正确;
D.①主反应;CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1,①×4得,4CH4(g)+2O2(g)═4CO(g)+8H2(g)△H=4△H1,②副反应:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2,这与反应②热化学方程式不一样,故△H2≠4△H1,故D错误,
故选AC.
点评 本题考查反应热的判断,结合热化学方程式判断反应放热还是吸热等,本题难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | B. | 四种元素一定属于短周期元素 | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 操作 | 现象 | 结论 | |
| A | 将含酚酞的Na2CO3溶液与BaCl2溶液混合 | 红色变浅 | Na2CO3溶液中存在水解平衡 |
| B | 将Cl2通入I2淀粉溶液中 | 溶液蓝色褪去 | Cl2有漂白性 |
| C | 向含等浓度的NaCl和KI溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 试管中加入少量淀粉和稀硫酸,冷却后加入NaOH溶液中和至碱性,再加入碘水 | 溶液未变蓝 | 淀粉己完全水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${V}_{N{H}_{3}}$=0.6mol/L•min | B. | ${V}_{{N}_{2}}$=0.005mol/L•s | ||
| C. | ${V}_{{H}_{2}}$=0.9mol/L•min | D. | ${V}_{N{H}_{3}}$=0.02mol/L•s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
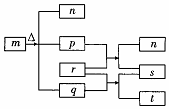 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径:Z>Y>X | B. | 最简单气态氢化物的稳定性:Y>X | ||
| C. | m、n、r都含有离子键和共价键 | D. | m、n、t都能破坏水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2 080 | 4 000 | 6 100 | 9 400 |
| R | 500 | 4 600 | 6 900 | 9 500 |
| S | 740 | 1 500 | 7 700 | 10 500 |
| T | 580 | 1 800 | 2 700 | 11 600 |
| U | 420 | 3 100 | 4 400 | 5 900 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 除杂试剂 | 实验方法 |
| A | 除去CuCO3固体中的(NH4)2CO3 | - | 置于坩埚中加热至恒重 |
| B | 除去Ag2S中少量AgCl | Na2S溶液 | 过滤 |
| C | 除去乙稀中的SO2气体 | 酸性高锰酸钾溶液 | 洗气 |
| D | 除去甘油中的乙酸 | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点801℃,易溶于水 | B. | 熔点10.31℃,液态不导电 | ||
| C. | 熔点112.8℃,能溶于CS2 | D. | 熔点97.81℃,固态能导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com