
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ①③⑥ |
分析 可逆反应CO(g)+Cl2(g)?COCl2(g)△H<0是气体体积缩小的放热反应,转化率的变化根据化学平衡的移动方向分析判断,
①升温平衡向吸热反应方向移动;
②恒容通入惰性气体,各组分的浓度不变,反应速率不变;
③增加CO的浓度,平衡 一氧化碳体积分数增大;
④加压平衡向气体体积缩小的方向进行,平衡正向进行;
⑤加催化剂,改变速率不改变平衡;
⑥恒压通入惰性气体,相对于减小反应体系压强,平衡逆向移动;
解答 解:化学反应CO(g)+Cl2(g)?COCl2(g)△H<0,正反应是气体体积减小的放热反应,
①升温平衡向逆反应移动,CO转化率减小,CO体积分数增大,故①正确;
②恒容通入惰性气体,各组分的浓度不变,平衡不移动,故②错误;
③增加CO的浓度,平衡向正反应方向移动,CO的体积分数增大,故③正确;
④加压平衡向正反应方向移动,CO的转化率增大,CO的体积分数减小,故④错误;
⑤加催化剂,改变速率不改变平衡,CO转化率不变,故⑤错误;
⑥恒压通入惰性气体,压强增大,为保持恒压,容器体积增大压强减小,平衡逆向进行,CO的转化率减小,CO的体积分数减小,故⑥正确;
故选D.
点评 本题考查了化学平衡的影响因素,题目难度中等,明确影响化学平衡的因素为解答关键,注意理解通入惰性气体对平衡移动影响,为易错点,试题培养了学生的灵活应用能力.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 12% | B. | 32% | C. | 44% | D. | 88% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸在见光或受热时会发生分解 | B. | 金属与硝酸反应不产生氢气 | ||
| C. | 可用铁和铝制品盛装浓硝酸 | D. | 铜与硝酸的反应属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①⑥ | C. | ②④ | D. | 只有① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<0 | |
| B. | 使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| C. | 降低温度,CO的平衡转化率降低 | |
| D. | 降低温度,各物质的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使新鲜的红玫瑰花褪色(HCl) | B. | 新制氯水呈浅黄绿色(Cl2) | ||
| C. | 加入小苏打固体,有气泡产生(H+) | D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
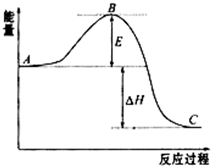 (1)已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、295kJ,则由氢气和碘反应生成1mol HI的反应热 为-1.5kJ/mol
(1)已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、295kJ,则由氢气和碘反应生成1mol HI的反应热 为-1.5kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com