
【题目】在一定温度下,将3 molCO2和2 mol H2混合于2 L恒容密闭容器中,发生如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。回答下列问题:
CO(g)+H2O(g)。回答下列问题:
(1)该反应的化学平衡常数表达式K=__________________________。
(2)已知700℃时,该反应的平衡常数K1=0.60,则该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
的平衡常数K2=____________,反应![]() CO2(g)+
CO2(g)+ ![]() H2(g)
H2(g)![]()
![]() CO(g)+
CO(g)+ ![]() H2O(g)的平衡常数K3=___________。
H2O(g)的平衡常数K3=___________。
(3)已知在1000℃时,该反应的平衡常数K4=1.0,则该反应为_________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是____________(填标号)。
a. 容器中压强不变 b.c(CO2)=c(CO)
c.CO2的生成速率等于H2的消耗速率 d.混合气体的平均相对分子质量不变
(5)在1000℃下,将3 molCO2和2 mol H2混合于2 L恒容密闭容器中,发生如下反应:CO2(g)+ H2(g)![]() CO(g)+ H2O(g),某时刻CO2的物质的量为2.0 mol,则此时v(正)__________v(逆) (填“>”“<”或“=”);该温度下反应达到平衡时,CO2的转化率为____________________。
CO(g)+ H2O(g),某时刻CO2的物质的量为2.0 mol,则此时v(正)__________v(逆) (填“>”“<”或“=”);该温度下反应达到平衡时,CO2的转化率为____________________。
【答案】 ![]() 1.67 0.77 吸热 c > 40%
1.67 0.77 吸热 c > 40%
【解析】试题分析:每个产物浓度系数次幂的连乘积与每个反应物浓度系数次幂的连乘积之比是平衡常数;(2)同温度下,正逆反应的平衡常数互为倒数; ![]() CO2(g)+
CO2(g)+ ![]() H2(g)
H2(g)![]()
![]() CO(g)+
CO(g)+ ![]() H2O(g)的平衡常数
H2O(g)的平衡常数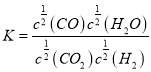 ;(3)700℃时,该反应的平衡常数K1=0.60、1000℃时, K4=1.0,升高温度平衡常数增大,说明平衡正向移动;(4)根据平衡标志分析;(5)利用“三段式”计算。
;(3)700℃时,该反应的平衡常数K1=0.60、1000℃时, K4=1.0,升高温度平衡常数增大,说明平衡正向移动;(4)根据平衡标志分析;(5)利用“三段式”计算。
解析:(1)该反应的化学平衡常数表达式K=![]() ;(2)同温度下,正逆反应的平衡常数互为倒数,700℃时,反应CO2(g)+H2(g)
;(2)同温度下,正逆反应的平衡常数互为倒数,700℃时,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K1=0.60,则CO(g)+H2O(g)
CO(g)+H2O(g)的平衡常数K1=0.60,则CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数=
CO2(g)+H2(g)的平衡常数=![]() 1.67; ;
1.67; ; ![]() CO2(g)+
CO2(g)+ ![]() H2(g)
H2(g)![]()
![]() CO(g)+
CO(g)+ ![]() H2O(g)的平衡常数
H2O(g)的平衡常数 0.77;(3)700℃时,该反应的平衡常数K1=0.60、1000℃时, K4=1.0,升高温度平衡常数增大,平衡正向移动,所以正反应吸热;(4)a. CO2(g)+H2(g)
0.77;(3)700℃时,该反应的平衡常数K1=0.60、1000℃时, K4=1.0,升高温度平衡常数增大,平衡正向移动,所以正反应吸热;(4)a. CO2(g)+H2(g)![]() CO(g)+H2O(g)反应前后气体物质的量不变,压强是恒量,所以容器中压强不变不一定平衡,故a错误; b.c(CO2)=c(CO)时,随时间延长浓度不一定保持不变,所以不一定平衡,故b错误; c.CO2的生成速率等于H2的消耗速率,正逆反应速率相等,一定达到平衡状态,故c正确; d. CO2(g)+H2(g)
CO(g)+H2O(g)反应前后气体物质的量不变,压强是恒量,所以容器中压强不变不一定平衡,故a错误; b.c(CO2)=c(CO)时,随时间延长浓度不一定保持不变,所以不一定平衡,故b错误; c.CO2的生成速率等于H2的消耗速率,正逆反应速率相等,一定达到平衡状态,故c正确; d. CO2(g)+H2(g)![]() CO(g)+H2O(g)反应前后气体物质的量、气体质量都不变 ,根据
CO(g)+H2O(g)反应前后气体物质的量、气体质量都不变 ,根据 ,平均相对分子质量是恒量, 混合气体的平均相对分子质量不变不一定平衡,故d错误。(5)在1000℃下,将3 molCO2和2 mol H2混合于2 L恒容密闭容器中,发生如下反应:CO2(g)+ H2(g)
,平均相对分子质量是恒量, 混合气体的平均相对分子质量不变不一定平衡,故d错误。(5)在1000℃下,将3 molCO2和2 mol H2混合于2 L恒容密闭容器中,发生如下反应:CO2(g)+ H2(g)![]() CO(g)+ H2O(g),某时刻CO2的物质的量为2.0mol,
CO(g)+ H2O(g),某时刻CO2的物质的量为2.0mol,

![]() ,所以
,所以![]() 平衡正向移动,v(正)>v(逆);
平衡正向移动,v(正)>v(逆);
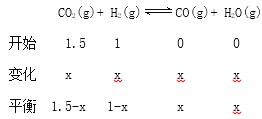
![]() ,x=0.6,CO2的转化率为
,x=0.6,CO2的转化率为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
B. 往碳酸镁中滴加稀盐酸:CO32-+2H+===CO2↑+H2O
C. 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知固体Na2SO3受热易分解,实验流程和结果如下:
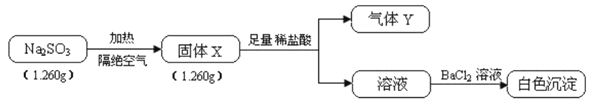
气体Y是一种纯净物,在标准状况下的密度为1.518g·L-1、请回答:
(1)气体Y分子的电子式___,白色沉淀的化学式_______。
(2)该流程中的Na2SO3受热分解的化学方程式__________。
(3)另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式____________(不考虑空气的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。

(1)A中试剂为________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂。上述操作的顺序是________(填序号);记录C的液面位置时,除平视外,还应________。
(4)B中发生反应的化学方程式为__________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”“偏小”或“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学常见的几种化合物,相关物质间的关系如下图所示(反应条件及部分产物均已略):

已知:X、Y是生活中常见的金属单质且X具有两性,A、B都是氧化物,A是红棕色粉末。回答下列问题:
(1)A的化学式为______________;
(2)若试剂b是稀硝酸。
①Y的单质与稀硝酸反应生成E时,Y单质必须过量,写出该反应的离子方程式__________________。如果稀硝酸过量,可以选择试剂________进行验证。
②D的阳离子能够与强碱、氯气反应,生成一种高效的净水剂YO42-,写出有关反应的离子方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中通过以下反应制得:3SiO2+6C+2N2![]() Si3N4+6CO,下列说法正确的是
Si3N4+6CO,下列说法正确的是
A. 在氮化硅的合成反应中,氮气是还原剂,二氧化硅是氧化剂
B. 上述反应中每生成1 mol氮化硅,氮气得到12 mol电子
C. 该反应属于四个基本反应类型之一
D. 该反应无有毒气体产生,不需要尾气处理装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实对应的离子方程式或电极反应式书写正确的是( )
A. 用石墨作电极电解CuSO4溶液2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B. 碳酸钠溶液显碱性:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D. 在强碱溶液中Fe(OH)3与NaClO反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )

A. a处通入氧气,b处通入氢气
B. P型半导体连接的是电池负极
C. 电池正极电极反应式为O2+2H2O+4e-===4OH-
D. 该装置中只涉及两种形式的能量转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: Fe2O3+2Al![]() Al2O3+2Fe,回答下列问题:
Al2O3+2Fe,回答下列问题:
(1)在该反应中____元素的化合价升高,该元素的原子_____电子,被____;
(2)在该反应中______元素的化合价降低,该元素的原子________电子,被________。
(3)该反应中,Fe2O3发生了________反应,Al发生了________反应。
(4)_______是氧化剂,_______是还原剂,_______是氧化产物,_______是还原产物。
(5)用单线桥标出电子转移的方向和数目______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com