
 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在. .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
分析 (1)①氯胺可看作是氨气分子上一个氢原子被氯原子取代的结构;根据反应热=反应物的总键能-生成物的总键能计算反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)的△H;
②根据氧化还原化合价升降分析NH2Cl与水反应生成强氧化性的物质;
(2)①根据温度对化学平衡的影响分析:温度升高,化学反应速率加快,平衡向着吸热方向移动;
②根据2NO(g)+C(s)?N2(g)+CO2(g),前后气体体积不变,相同温度下,甲与乙为等效平衡,故乙平衡时NO的物质的量为甲平衡时的一半,为0.4mol;
(3)①化学平衡常数K只于温度有关,温度不变,K不变;
②根据压强对化学平衡的影响分析可得;
(4)已知C点NO2和CO2的物质的量浓度相等,据此列三段式计算平衡时各物质的物质的量,再计算Kp.
解答 解:(1)①氯胺可看作是氨气分子上一个氢原子被氯原子取代的结构,则氯胺的电子式为: ;NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g),△H=反应物的键能之和-生成物的键能之和=(3×391.3+243.0)-(2×391.3+191.2+431.8)=+11.3 kJ•mol-1;
;NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g),△H=反应物的键能之和-生成物的键能之和=(3×391.3+243.0)-(2×391.3+191.2+431.8)=+11.3 kJ•mol-1;
故答案为: ;+11.3 kJ•mol-1;
;+11.3 kJ•mol-1;
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为NH2Cl+H2O?NH3+HClO;
故答案为:NH2Cl+H2O?NH3+HClO;
(2)①丙容器与甲容器投入量相同,达到平衡所用时间较短,说明丙容器温度较高,丙容器平衡时NO的浓度比甲容器高,说明温度升高后向着逆方向移动,即逆方向为吸热方向,该反应是个放热反应;
故答案为:放热;
②根据2NO(g)+C(s)?N2(g)+CO2(g),前后气体体积不变,相同温度下,甲与乙为等效平衡,故乙平衡时NO的物质的量为甲平衡时的一半,为0.4mol,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=$\frac{(1mol-0.4mol)÷1L}{200min}$=0.003 mol•L-1•min-1;
故答案为:0.003 mol•L-1•min-1;
(3)①A、B两点的温度相同,平衡常数K只与温度有关,故浓度平衡常数关系:Kc(A)=Kc(B);
故答案为:=;
②反应2NO2(g)+2C(s)?N2(g)+2CO2(g)是个气体体积增大的反应,增大压强平衡逆向移动,故A、B、C三点中NO2的转化率最高的是A点;
故答案为:A;
③1mol NO2和足量C发生该反应,设反应二氧化氮x,列三段式:
2NO2(g)+2C(s)?N2(g)+2CO2(g)
n始:1 0 0
n转:x 0.5x x
n平:1-x 0.5x x
从图知C点时NO2和CO2的物质的量浓度,则1-x=x,解得x=0.5,则平衡时总的物质的量为1.25mol,C点时该反应的压强平衡常数Kp(C)=$\frac{(\frac{0.5mol}{1.25mol}×10MPa)^{2}×(\frac{0.25mol}{1.25mol}×10MPa)}{(\frac{0.5mol}{1.25mol}×10MPa)^{2}}$=2MPa;
故答案为:2 MPa;
点评 本题考查了反应热的计算、化学平衡状态的判断、化学平衡移动以及化学平衡常数、化学方程式的书写等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液 | |
| B. | pH<7的溶液 | |
| C. | c(OH-)<c(H+)的溶液 | |
| D. | 25℃时,由水电离出来的c(H+)=1×10-9mol/L的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
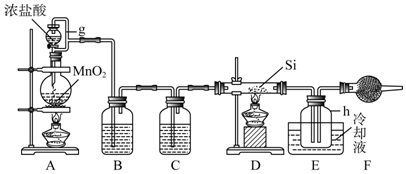
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl3 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -17.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 163 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-H | 414 | C-F | 489 | H-F | 565 | F-F | 158 |
| H-H | 436 | H-N | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
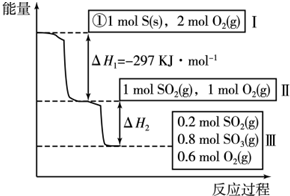 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | 4mol SO2、2mol O2、 |
| 平衡时n(SO3) | 1.6mol | n2 | n3 |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| SO2或SO3的转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
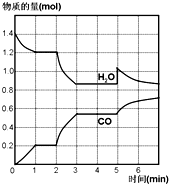 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
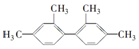 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有16个碳原子处于同一平面上 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃不属苯的同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com