
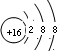
 .X与Y形成的离子化合物的电子式为
.X与Y形成的离子化合物的电子式为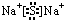 ,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.
,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.分析 X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,在该氢化物中,X显-2价,则X为第VIA族元素,且为短周期元素,所以X是O或S元素,此氢化物的相对分子质量与X最高价氧化物的相对分子质量之比为17:40,O元素没有氧化物,所以X是S元素,X原子核内质子数与中子数相等,则X是1632S,Y与X可以形成离子化合物Y2X,在该化合物中,Y显+1价,Y是短周期元素,则Y为第IA族元素,Y的阳离子电子层结构与Ne相同,所以Y是Na元素,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子,则Z位于第三周期第VIIA族,为Cl元素,结合元素、物质的结构性质分析解答.
解答 解:X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,在该氢化物中,X显-2价,则X为第VIA族元素,且为短周期元素,所以X是O或S元素,此氢化物的相对分子质量与X最高价氧化物的相对分子质量之比为17:40,O元素没有氧化物,所以X是S元素,X原子核内质子数与中子数相等,则X是1632S,Y与X可以形成离子化合物Y2X,在该化合物中,Y显+1价,Y是短周期元素,则Y为第IA族元素,Y的阳离子电子层结构与Ne相同,所以Y是Na元素,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子,则Z位于第三周期第VIIA族,为Cl元素,
(1)通过以上分析知,X、Y、Z分别为硫、钠、氯元素,
故答案为:S;Na;Cl;
(2)X是S元素,硫离子核外有18个电子,硫离子的结构示意图为 ,化合物Na2S属于离子化合物,硫离子和钠离子之间只含离子键,则硫化钠的电子式为
,化合物Na2S属于离子化合物,硫离子和钠离子之间只含离子键,则硫化钠的电子式为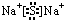 ,Z的最高价氧化物对应的水化物为HClO4,Y的最高价氧化物对应的水化物为NaOH,它们反应的离子方程式为H++OH-=H2O,
,Z的最高价氧化物对应的水化物为HClO4,Y的最高价氧化物对应的水化物为NaOH,它们反应的离子方程式为H++OH-=H2O,
故答案为: ;
;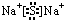 ;H++OH-=H2O;
;H++OH-=H2O;
(3)Y单质是钠,钠在空气中燃烧生成过氧化钠,化学式为Na2O2,过氧化钠可以作为面具中的制氧剂,反应方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:Na2O2;2Na2O2+2CO2=2Na2CO3+O2;
(4)氯气能和硫化钠发生氧化还原反应生成硫单质和氯化钠,反应的离子方程式为Cl2+S2-=S↓+2Cl-,
故答案为:Cl2+S2-=S↓+2Cl-;
(5)由于硫的非金属性弱于氯,所以硫化氢的还原性强于氯化氢,
故答案为:H2S.
点评 本题考查了方程式、化学式的书写,正确推断元素是解本题关键,难点的过氧化钠电子式的书写,注意过氧根离子电子式的书写特点,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 可以在元素周期表中金属与非金属元素分界线附近寻找合适的半导体材料 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水结成冰体积膨胀 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑦⑧ | B. | ③⑥⑦ | C. | ③⑥⑦⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中一定不含有离子键,离子化合物中可能含有共价键 | |
| B. | 一定条件下,将1 mol N2与3 mol H2充入密闭容器中充分反应可生成2 mol NH3 | |
| C. | 充电电池的化学反应原理是氧化还原反应 | |
| D. | Na2O和Na2O2晶体中阳离子与阴离子个数比均为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
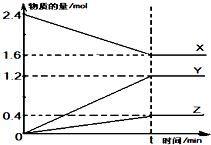 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com