
【题目】(1)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示___________________。
(2)若FeSO4和O2的系数比为2∶1,试配平下列方程式:
![]() FeSO4+
FeSO4+![]() K2O2→
K2O2→![]() K2FeO4+
K2FeO4+![]() K2O+
K2O+![]() K2SO4+
K2SO4+![]() O2↑ __________________
O2↑ __________________
(3)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,现有NO与NO2的混合气体,将其通入50 mL 2 mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3- 0.02 mol。
①所得溶液中NaNO2的物质的量为________ mol;
②混合气体中V(NO)∶V(NO2)=________。
(4)As2O3俗称砒霜,As2O3是两性偏酸性氧化物,是亚砷酸(H3AsO3)的酸酐,易溶于碱生成亚砷酸盐,写出As2O3与足量氢氧化钠溶液反应的离子方程式___________。
【答案】CO2+Na2SiO3+H2O=Na2CO3+H2SiO3↓ 2 6 2 2 2 1 0.08 3∶7 As2O3+6OH-=2AsO33-+3H2O
【解析】
(1)非金属性越强,最高价氧化物对应的水化物的酸性越强,根据强酸制弱酸设计反应原理。
(2)根据得失电子数相等配平化学方程式。
(3)①根据Na元素质量守恒来计算即可。②根据NaNO2和NaNO3的物质的量,利用反应的化学方程式解答即可。
(4)两性氧化物与碱反应生成盐和水。
(1)非金属性越强,最高价氧化物对应的水化物的酸性越强,利用CO2+Na2SiO3+H2O=Na2CO3+H2SiO3↓可知,碳酸的酸性大于硅酸,即C的非金属性比Si强。
(2) FeSO4中Fe的化合价为+2价,K2FeO4中Fe的化合价为+6价,所以一个FeSO4失去4个电子;K2O2中O的化合价为-1价,O2中O的化合价为0价,一个K2O2失去2个电子生成O2;K2O2中O的化合价为-1价,K2FeO4和K2O中O的化合价为-2价,所以每个K2O2得到2个电子,由FeSO4和O2的系数比为2∶1可知一共失去10个电子,那么需要5个K2O2得到电子,1个K2O2失去电子,即K2O2的系数为6,然后再根据原子种类和数目不变配平其他物质的系数,即为2FeSO4+6K2O2=2K2FeO4+2K2O+2K2SO4+O2↑。
(3)①n(NaNO3)=n(NO3-)=0.02mol,n(NaOH)=0.05L×2mol/L=0.1mol,根据Na元素质量守恒,则n(NaOH)=n(NaNO3)+n(NaNO2),n(NaNO2)=0.1mol-0.02mol=0.08mol,故答案为:0.08。
②设混合物中NO的物质的量为x mol,NO2的物质的量为y mol,
NO2+NO+2NaOH=2NaNO2+H2O
1 1 2
x x 2x
2NO2+2NaOH= NaNO2 + NaNO3 + H2O
2 1 1
y-x ![]() ( y-x)
( y-x) ![]() ( y-x)
( y-x)
2x+![]() ( y-x)=0.08,
( y-x)=0.08,![]() ( y-x)=0.002,解得x=0.03,y=0.07。在相同条件下物质的量之比等于体积之比,混合气体中V(NO)∶V(NO2)=3∶7。
( y-x)=0.002,解得x=0.03,y=0.07。在相同条件下物质的量之比等于体积之比,混合气体中V(NO)∶V(NO2)=3∶7。
(4)As2O3与足量氢氧化钠溶液反应生成亚砷酸钠和水,反应的离子方程式为:As2O3+6OH-=2AsO33-+3H2O


科目:高中化学 来源: 题型:
【题目】超氧化钾KO2也和过氧化钠一样,吸收CO2变成碳酸盐并放出O2 . 若有0.5molKO2与过量CO2反应,则产生O2的物质的量为( )
A.0.125mol
B.0.375mol
C.0.5mol
D.0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca10(PO4)6(OH)2(羟基磷酸钙,简写HAP)是一种新型的环境功能矿物材料,可用于除去水体中的F-、Cd2+、Pb2+及Cu2+等。
(1)制备HAP的步骤如下:分别配制250mL浓度均为0.5 mol·L-1的Ca(NO3)2溶液和(NH4)2HPO4溶液(pH约为8),按n(Ca)/n(P)=1.67分别量取相应体积的溶液,加热至50℃,不断搅拌下,按特定的方式加料,强力搅拌1h,再经后续处理得到产品。
①特定的加料方式是__________ (填序号)。
a.将Ca(NO3)2溶液逐滴滴入(NH4)2HPO4溶液中,再用氨水调节pH至10.5
b.将(NH4)2HPO4溶液逐滴滴入Ca(NO3)2溶液中,再用氨水调节pH至10.5
c.将(NH4)2HPO4溶液和氨水混合并调节pH至10.5,再滴入Ca(NO3)2溶液
②反应生成Ca10(PO4)6(OH)2的离子方程式为__________。
(2)HAP脱除F-的操作是:在聚四氟乙烯烧杯中加入50mL10mg·L-1NaF溶液和0.15gCa10(PO4)6(OH)2,在恒温下振荡,每隔1h测定一次溶液中F-浓度,直至达到吸附平衡。
①实验中“烧杯”材质用“聚四氟乙烯”塑料而不用玻璃,其原因是__________。
②除氟反应形式之一是:Ca10(PO4)6(OH)2+20F-![]() 10CaF2+6PO43-+2OH-,该反应的平衡常数K=__________[用Ksp(CaF2)和Ksp(HAP)表示]。
10CaF2+6PO43-+2OH-,该反应的平衡常数K=__________[用Ksp(CaF2)和Ksp(HAP)表示]。
(3)HAP脱除Pb(Ⅱ)包括物理吸附和溶解-沉淀吸附。物理吸附时,HAP的特定位可吸附溶液中某些阳离子;溶解-沉淀吸附的机理为:
Ca10(PO4)6(OH)2(s)+2H+(aq)![]() 10Ca2+(aq)+6PO43-(aq)+2H2O(l)(溶解)
10Ca2+(aq)+6PO43-(aq)+2H2O(l)(溶解)
10Pb2+(aq)+6PO43-(aq)+2H2O(l)![]() Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
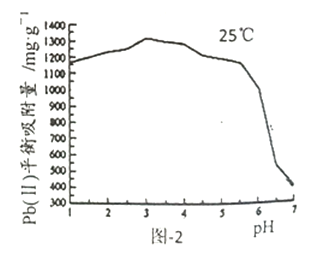
已知Pb(Ⅱ)的分布分数如图-1所示;一定条件下HAP对Pb(1)平衡吸附量与pH的关系如图-2所示。
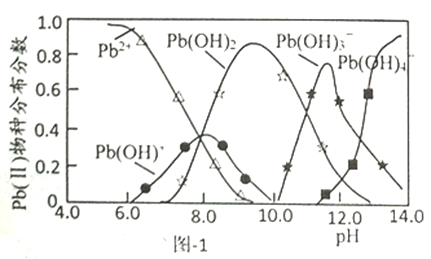
①能使甲基橙显红色的Pb(Ⅱ)溶液中滴入少量NaOH至溶液呈中性,该过程中主要反应的离子方程式为__________。
②当pH<3.0时,pH越小HAP对Pb(Ⅱ)平衡吸附量稍减小,其原因是__________。
③当pH>7.0时,生成的沉淀为__________(填化学式);此时pH越大HAP对Pb(Ⅱ)平衡吸附量越小,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是( )
A.二氧化碳气体通入无色酚酞溶液,溶液变红色
B.细铁丝在氧气里剧烈燃烧,火星四射
C.点燃棉线闻到一股烧焦的羽毛味
D.打开浓盐酸试剂瓶的瓶塞,瓶口上方出现大量白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中错误的是
A.原电池是将化学能转变为电能的装置
B.构成原电池的正极和负极必须是两种不同的金属
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.原电池放电时,外电路中电流的方向是从正极到负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的相关化合物在生产生活中具有重要的作用。
回答下列问题:
(1)铜元素在周期表中的位置是____,基态铜原子中,核外电子占据最高能层的符号是___,占据该最高能层的电子数为_________。
(2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu6Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___(填“晶体”或”非晶体”)。
(3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为_____。
(SCN)2对应的酸有硫氰酸(H-S-C≡N)、异硫氰酸(H-N=C=S)两种,理论上前者沸点低于后者,其原因是__________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子个数为__。
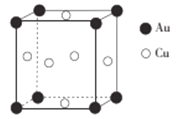
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为anm,该金属互化物的密度为_____________(用含a、NA的代数式表示)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃类有机物在生活和生产中发挥着重要作用,研究它们意义重大。请回答下列问题:
(1)写出乙烷制氯乙烷的方程式______________________________,其反应类型为____________。
(2)写出以乙醇为原料经过两步反应制备乙烯的方程式,并指出第二步反应的反应类型。
第一步:__________________________________;
第二步:______________________,其反应类型为___________________。
(3)0.2mol某烃A在氧气中宋个燃烧后,生成CO2利H2O各1.2mol。若烃A不能使溴水褪色,但在一定条化下能与氯气发生取代反应,其一氯取代物有两种,则烃A的结构简式为___________________。
(4)在一定条件下,某些不饱和烃分子可以进行自身加成反应。例如:
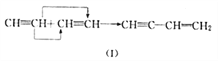
①参照(I)则有机物A![]() ,可由____________(填结构简式)相互加成制取。
,可由____________(填结构简式)相互加成制取。
②参照(I)当两分子丙烯发生自身加成时生成主链为4个碳原子的烃B,则B的结构简式为______,用系统命名法命名B_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com