
分析 (1)强碱性溶液中OH-能分别与NH4+、Al3+、反应,则溶液中不存在NH4+、Al3+;
①取少量的溶液用硝酸酸化后,该溶液无沉淀生成,则溶液中不含SiO32-;
②开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失,则存在AlO2-、CO32-;
(2)n(HCl)=0.005L×0.2mol/L=0.001mol,而n(AgCl)=$\frac{0.187g}{143.5g/mol}$=0.0013mol,则含有氯离子;再结合溶液不显电性来分析解答;
(3)根据实验现象确定存在的离子并书写离子方程式.
解答 解:(1)强碱性溶液中OH-能分别与NH4+、A13+、反应,则溶液中不存在NH4+、A13+;
①取少量的溶液用硝酸酸化后,该溶液无沉淀生成,因硅酸为沉淀,则溶液中不含SiO32-;
②开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失,则偏铝酸根离子与酸反应生成沉淀,然后碳酸根离子与酸反应生成气体,再沉淀与酸反应而溶解,所以原溶液中存在AlO2-、CO32-;又溶液不显电性,则一定存在阳离子,即存在K+,
原溶液中肯定存在的是:AlO2-、CO32、K+、OH-,肯定不存在的是NH4+、A13+、SiO32-.
故答案为:AlO2-、CO32、K+、OH-;NH4+、A13+、SiO32-;
(2)n(HCl)=0.005L×0.2mol/L=0.001mol,而n(AgCl)=$\frac{0.187g}{143.5g/mol}$=0.0013mol,则含有氯离子,故答案为:n(HCl)=0.005L×0.2mol/L=0.001mol,而n(AgCl)=$\frac{0.187g}{143.5g/mol}$=0.0013mol,则一定含有氯离子.
(3)试验中生成沉淀的反应有:AlO2-+H++H2O=Al(OH)3↓,Ag++Cl-═AgCl↓,故答案为:AlO2-+H++H2O=Al(OH)3↓,Ag++Cl-═AgCl↓.
点评 本题考查了常见离子的检验,注意离子的特征离子反应以及现象、离子之间的干扰是关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
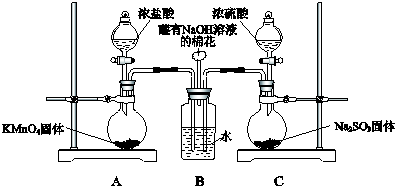
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
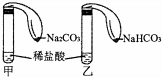 为对比Na2CO3与NaHCO3的性质,实验小组的同学们在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口.将气球内的Na2CO3或NaHCO3倒入试管中(如图).
为对比Na2CO3与NaHCO3的性质,实验小组的同学们在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口.将气球内的Na2CO3或NaHCO3倒入试管中(如图).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下NaHCO3比Na2CO3更 稳定 | |
| B. | 向等量的Na2CO3和NaHCO3固体中分别滴加同浓度的盐酸,后者产生气泡速率快 | |
| C. | 相同条件下NaHCO3比Na2CO3更易溶于水 | |
| D. | 经实验测定,Na2CO3溶液显碱性,说明Na2CO3属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
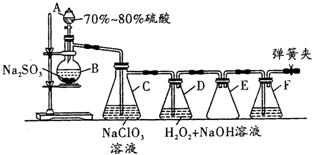 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
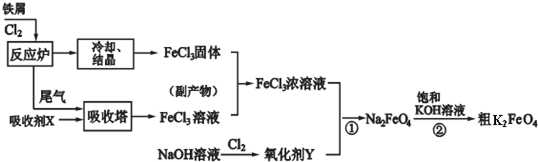
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为16、中子数为17的硫原子:$\stackrel{17}{16}S$ | |
| B. | 硫离子(S2-)的结构示意图: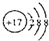 | |
| C. | 二硫化碳分子的结构式:S=C=S | |
| D. | 硫化氢分子的电子式: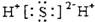 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4(mol/L) 2 | B. | 16(mol/L) 2 | C. | 20(mol/L) 2 | D. | 25(mol/L) 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应中NF3是氧化剂,H2O是还原剂 | |
| B. | 反应中被氧化与被还原的原子物质的量之比为2:1 | |
| C. | 若反应中生成0.2molHNO3,则反应共转移0.4mol电子 | |
| D. | NF3在潮湿空气中泄漏会产生红棕色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com