
下列实验方案不能成功的是( )
A通过测浓度均为0.01 mol·L-1的溶液的pH大小来鉴别盐酸和乙酸
B向均含石蕊的盐酸和乙酸溶液中分别加入NaCl、CH3COONa来鉴别盐酸和乙酸是否为弱电解质
C加热蒸发FeCl3溶液制备FeCl3晶体
D测浓度均为0.1 mol·L-1的NaCl、CH3COONa溶液的pH来鉴别盐酸和乙酸是否为弱电解质
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.信息产业中的光缆的主要成分是单质硅
B.利用激光笔可以区别鸡蛋清和浓盐水
C.油脂、糖类、蛋白质都属于天然高分子化合物
D.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
在一容积为2 L的密闭容器中,加入0.2 mol N2和0.6 mol H2,在一定条件下发生反应:N2(g)+3H2(g)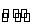 2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中 NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
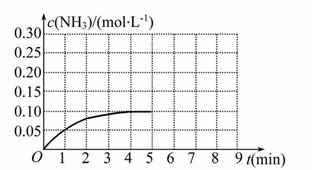
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N H3)为_________。
H3)为_________。
(2)该反应达到平衡时H2的转化率__ ______。
______。
(3)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为___________。(填序号)
A.0.20 mol·L-1 B.0.12 mol·L-1
C.0.10 mol·L-1 D.0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
(5)若该反应在298 K、398 K时的化学平衡常数分别为K1、K2,则K1______K2(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于氯化铁水解的说法错误的是( )
A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动
B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
C.有50 ℃和20 ℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
D.为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
 (1)NH4Al(SO4)2可作净水剂,其原理是___________________________
(1)NH4Al(SO4)2可作净水剂,其原理是___________________________
_
(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2溶液中c(NH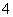 )________(填“等于”、“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中c(NH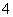 )。
)。
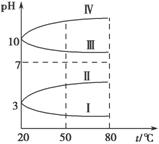
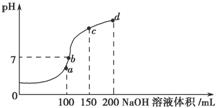
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填字母),导致pH随温度变化的原因是 ;
 ②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(SO
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(SO )-c(NH
)-c(NH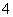 )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示.试分析图中a、b、c、d四个点,水的电离程度最大的是________点,在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
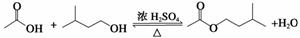
| 相对分 子质量 | 密度/ (g·cm-3) | 沸点/℃ | 水中 溶解性 | |
| 异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
| 乙酸 | 60 | 1.049 2 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
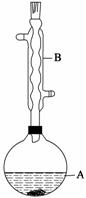
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是________。
(2)在洗涤操作中,第一次水洗的主要目的是__________________________________,
第二次水洗的主要目的是__________________________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是__________________________________________。
(5)实验中加入少量无水MgSO4的目的是_______________________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是______(填标号)。
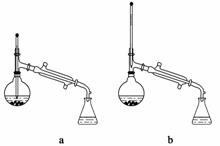
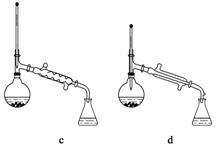
(7)本实验的产率是________(填标号)。
a.30% b.40%
c.60% d.90%
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,会使实验的产率偏____(填“高”或“低”) ,其原因是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中一定能大量共存的离子组是( )
A.使pH试纸呈红色的溶液:Na+、Al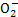 、S
、S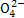 、Cl-
、Cl-
B.澄清透明溶液:Cr2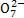 、S
、S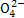 、K+、N
、K+、N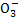
C.pH=0的溶液:Na+、C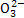 、Fe3+、N
、Fe3+、N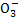
D.水电离产生的c(H+)=1×10-12mol·L-1的溶液:HC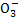 、N
、N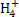 、Cl-、Ca2+
、Cl-、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作不能达到目的的是( )
A.除去MgCl2酸性溶液中的Fe3+:加热搅拌,加入MgCO3,过滤,加适量的盐酸
B.制备硅酸胶体:向硅酸钠水溶液中逐滴滴加稀盐酸至溶液呈强酸性
C.检验Fe2(SO4)3溶液中是否含有FeSO4:滴加少许酸性高锰酸钾溶液,并振荡
D.使盛有少量氢氧化镁沉淀的试管中的沉淀溶解:加入一定量的氯化铵溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com