
【题目】细菌冶金是近年来新兴的绿色冶金工艺,它主要是应用细菌法溶浸贫矿、废矿、尾矿和炉渣等,以回收某些贵重有色金属和稀有金属,节约矿产资源,最大限度地利用矿藏的一种冶金方法。其中细菌治铜的生产流程为:
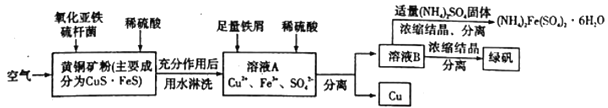
(1)上述生产流程中有三步用到了同一种分离方法,实验室中不能用这种分离方法来分离液态胶体中分散质的原因是______________________________。
(2)绿矾(FeSO4·7H2O)是一种良好的还原剂,也可用来制取治疗缺铁性贫血的药剂和食品调味剂。在保存绿矾时,必须_______________________。在溶液B中加入适量(NH4)2 (SO4)2固体,加热浓缩时,可以得 到(NH4)2Fe(SO4)4·6H2O的原因是________________________________________________。
(3)溶液B中一定含有的阳离子是________________。若在溶液A中加入少量铁屑只发生其中的一个反应,则此反应的平衡常数的表达式为_______________________________。
(4)写出黄铜矿中的CuS·FeS在氧化亚铁硫杆菌(Thiobacillus ferrooxidans,简写为T.f)作用下被空气氧化生成溶液A的离子方程式:___________________________________。
(5)氧化亚铜可用作船底防污漆,以杀死低级海生动物而保护船体,可用作陶瓷和搪瓷的着色剂和红色 玻璃的染色剂,氧化亚铜也是一种重要的半导体材料。请用浓的强碱溶液,根据2Cu+H2O![]() Cu2O+H2↑反应,设计出工业生产氧化亚铜的一种方法:___________________________________ (只要求画实验装置图,,其它必要材料任选)。
Cu2O+H2↑反应,设计出工业生产氧化亚铜的一种方法:___________________________________ (只要求画实验装置图,,其它必要材料任选)。
【答案】 胶体的分散质(或胶体粒子)能通过滤纸孔隙 密封保存,防止被空气中氧气氧化 相同温度下,硫酸亚铁铵在水中的溶解度比FeSO4和(NH4)2SO4的溶解度小 Fe2+(或多写H+) 表达式为:K=c3(Fe2+) /c2(Fe3+) 4CuS·FeS+17O2+4H+![]() 4Cu2++4Fe3++8SO42-+2H2O
4Cu2++4Fe3++8SO42-+2H2O 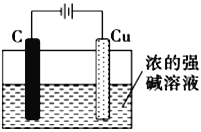 (电极与电源电极不得接错,阴极材料必须合理)
(电极与电源电极不得接错,阴极材料必须合理)
【解析】试题分析:(1)上述生产流程中有三步用到了同一种分离方法是过滤,胶体粒子能通过滤纸;(2)绿矾是一种良好的还原剂,易被氧化;相同温度下,硫酸亚铁铵在水中的溶解度比FeSO4和(NH4)2SO4的溶解度小;(3)溶液A中的Fe3+、Cu2+都能与铁屑反应生成Fe2+;氧化性Fe3+>Cu2+,加入少量铁屑只发生![]() 反应;(4)CuS·FeS在氧化亚铁硫杆菌作用下被空气氧化生成Fe3+、Cu2+、SO42-;(5)根据2Cu+H2O
反应;(4)CuS·FeS在氧化亚铁硫杆菌作用下被空气氧化生成Fe3+、Cu2+、SO42-;(5)根据2Cu+H2O![]() Cu2O+H2↑反应,铜失电子发生氧化反应,所以要用铜作阳极;
Cu2O+H2↑反应,铜失电子发生氧化反应,所以要用铜作阳极;
解析:(1)上述生产流程中有三步用到了同一种分离方法是过滤,胶体粒子能通过滤纸,所以不能用过滤法来分离液态胶体中分散质;(2)绿矾是一种良好的还原剂,易被氧化,所以保存绿矾时,必须密封保存,防止被空气中氧气氧化;相同温度下,硫酸亚铁铵在水中的溶解度比FeSO4和(NH4)2SO4的溶解度小,所以在溶液B中加入适量(NH4)2 SO4固体,加热浓缩时,可以得到(NH4)2Fe(SO4)2·6H2O;(3)溶液A中的Fe3+、Cu2+都能与铁屑反应生成Fe2+,所以加入足量铁粉后溶液中一定有Fe2+;氧化性Fe3+>Cu2+,加入少量铁屑只发生![]() 反应,平衡常数的表达式为:K=c3(Fe2+) /c2(Fe3+);(4)CuS·FeS在氧化亚铁硫杆菌作用下被空气氧化生成Fe3+、Cu2+、SO42-,反应离子方程式是4CuS·FeS+17O2+4H+
反应,平衡常数的表达式为:K=c3(Fe2+) /c2(Fe3+);(4)CuS·FeS在氧化亚铁硫杆菌作用下被空气氧化生成Fe3+、Cu2+、SO42-,反应离子方程式是4CuS·FeS+17O2+4H+![]() 4Cu2++4Fe3++8SO42-+2H2O;(5)根据2Cu+H2O
4Cu2++4Fe3++8SO42-+2H2O;(5)根据2Cu+H2O![]() Cu2O+H2↑反应,铜失电子发生氧化反应,可用电解法制备氧化亚铜,用铜作阳极,工业生产氧化亚铜的装置图是
Cu2O+H2↑反应,铜失电子发生氧化反应,可用电解法制备氧化亚铜,用铜作阳极,工业生产氧化亚铜的装置图是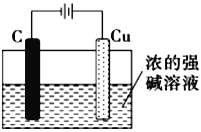 ;
;


科目:高中化学 来源: 题型:
【题目】(1)1.5 mol氧气中含有的O2的个数为_____________,标准状况下体积为_________L,与_____________gH2O所含的原子总数相等。
(2)在标准状况下,体积为6.72L的NO和NO2混合气,质量为11.88g,则NO和NO2的体积比为___________。
(3)同温同压下,两种气体A和B的体积之比为2∶1,质量之比为8∶5,则A与B的密度之比为________,摩尔质量之比为_______。
(4)某状况下,2g二氧化碳气体的体积是1120 mL,2gA气体的体积是770 mL,A的摩尔质量是______________。
(5)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内,某些重要化合物的元素组成及相互关系十分密切。请据右图
分析完成下列问题。

(1)图中X、Y分别代表何种元素?X ,Y 。
(2)请在B下面的括号内填写该类物质的另外三种功能。
(3)B类物质有多种不同功能,究其原因是因为A类物质内的 不同。
(4)细胞内遗传信息的携带者是图中的 物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序不正确的是( )
A.元素的非金属性:N<O<F
B.酸性:HClO4>H2SO4>H3PO4
C.热稳定性:HF>HCl>H2S
D.原子半径:Al>Mg>Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述中正确的是
A. 标准状况下,2.24 LCCl4中含有的氯原子数为0.4NA
B. 常温常压下,36g等体积混合的CO与CO2混合气体中含有的氧原子数为1.5NA
C. 1molFe与足量氯气反应时转移的电子数为2NA
D. 1L1mol·L-l的NaClO溶液中含有ClO-的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不符合节能减排的是( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了抵御海水的侵蚀,往往会在船体上安装大型的锌块,利用原电池反应:2Zn+2H2O+O2 = 2Zn(OH)2,下列说法正确的是
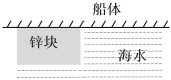
A. 锌块作为原电池的负极,发生还原反应而被腐蚀
B. 海水中的电解质如NaCl起到了导电的作用
C. 正极的电极反应式为:Zn - 2e-=Zn2+
D. 实际应用中,需用锌块覆满船体,完全隔绝海水以防止钢铁被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子序数为87的元素的说法正确的是( )
A.它位于第六周期第ⅡA族B.它位于第七周期第ⅡA族
C.它位于第七周期第ⅠA族D.它的原子最外层有3个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在5种离子:NO3-、SO42-、Fe3+、H+和R离子,其物质的量之比为2:3:1:3:1,则R可能为
A. Ca2+ B. Mg2+ C. Cl- D. Ba2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com