
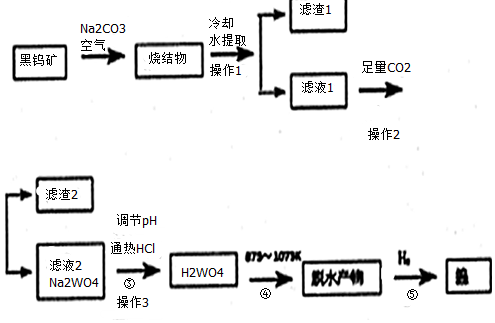
分析 黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4).含有SiO2、Al2O3等杂质在空气中加入氢氧化钠熔融,烧结物成分为:Fe2O3、Mn2O4、NaAlO2、Na2SiO3、Na2WO4,冷却溶解过滤得到滤液A,在pH值3.0~4.4的热溶液中,用盐酸沉淀出钨酸B与杂质分离,灼烧后即为三氧化钨,氢气还原氧化钨得到金属钨,
(1)烧结物中生成Na2SiO3的化学反应是二氧化硅和碱反应生成,如碳酸钠和二氧化硅混合加热反应生成硅酸钠和二氧化碳,生成Mn3O4的化学反应是依据反应4FeWO4+4Na2CO3+O2═4Na2WO4+4CO2+2Fe2O3类推得到;
(2)操作3为过滤,据此选择需要的仪器;
(3)滤液1中通入过量二氧化碳是溶液中偏铝酸根离子和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,二氧化碳和硅酸根离子反应生成白色沉淀硅酸;
(4)脱水产物为WO3,通入氢气还原生成钨金属,属于热还原法;
(5)钨的氧化物WO(3-x)中x=0.1,则钨的氧化物为WO2.9,根据十字交叉法来计算回答.
解答 解:(1)烧结物中生成Na2SiO3的化学反应是二氧化硅和碱反应生成,如碳酸钠和二氧化硅混合加热反应生成硅酸钠和二氧化碳,烧结物中生成Na2SiO3的化学反应方程式为:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,生成Mn3O4的化学反应是结合反应4FeWO4+4Na2CO3+O2═4Na2WO4+4CO2+2Fe2O3,类推得到,生成Mn2O4与生成Fe2O3所发生的反应原理相同,生成Mn3O4的化学反应方程式为:6MnWO4+6NaCO3+O2=6Na2WO4+6CO2+2Mn3O4,
故答案为:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;6MnWO4+6NaCO3+O2=6Na2WO4+6CO2+2Mn3O4;
(2)操作3为分离溶液和固体的过滤操作,需要用到玻璃仪器的有:玻璃棒、烧杯、漏斗,
故答案为:玻璃棒、烧杯、漏斗;
(3)滤液1中通入过量二氧化碳是溶液中偏铝酸根离子和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,通入足量CO2时发生的离子反应方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,二氧化碳和硅酸根离子反应生成白色沉淀硅酸,反应的离子方程式为:CO2+SiO32-+H2O=H2SiO3↓+2HCO3-,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;CO2+SiO32-+H2O=H2SiO3↓+2HCO3-;
(4)分析可知,H2WO4脱水产物为WO3,通入氢气还原生成钨金属,WO3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$W+3H2O冶炼的方法,属于热还原法,故答案为:热还原法;
(5)钨的氧化物WO(3-x)中x=0.1,则钨的氧化物为WO2.9,可用十字交叉法求算: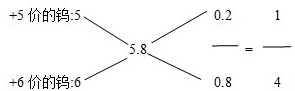 ,
,
故答案为:1:4
点评 本题意工艺流程题为载体,综合考查学生氧化还原以及金属的冶炼等方面的知识,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH2F2的电子式: | |
| B. | 质子数为53、中子数为72的碘原子:${\;}_{53}^{125}$I | |
| C. | 16O的原子结构示意图: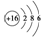 | |
| D. | 间羟基苯甲醛的结构简式: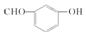 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3.4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 该溶液中[SO42-]:([Cu2+]+[Fe2+]+[Fe3+])>5:4.([SO42-]表示SO42-物质的量浓度 ) | |
| C. | 向该溶液中加入适量氯水,并调节pH到3.4过滤,可获得纯净的CuSO4溶液 | |
| D. | 在pH=4的溶液中Fe3+不能大量存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(Z) | n(Y) | ||
| ① | 600 | 1 | 0 | 0 | 0.8 |
| ② | 600 | 0.1 | a | 0.9 | 0.8 |
| ③ | 600 | 0 | 1.5 | 1.5 | b |
| ④ | 500 | 0.5 | 1.2 | 1.0 | c |
| A. | 实验②起始时V(逆)<v(正)且a=0.9 | |
| B. | 600℃时,该反应平衡常数K=3.2 moI/L | |
| C. | 实验③中b<1.2 | |
| D. | 若b>c,则△H<O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Z的原子结构示意图为
,Z的原子结构示意图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| t/s | 0 | 500 | 1000 |
| c(N2O5/mol/L) | 5.00 | 3.50 | 2.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
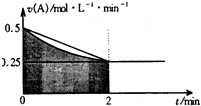 某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )
某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )| A. | 图中阴影部分的面积表示0-2min内A的物质的量浓度的减小值 | |
| B. | 反应开始的前2min,A的平均反应速率小于0.375mol•L-1•min-1 | |
| C. | 至2min时,A的物质的量减小值介于0.5mol至1mol之间 | |
| D. | 至2min时,c(B)介于1mol•L-1 至1.5mol•L-1 之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是人体不可缺少的营养物质 | |
| B. | 油脂的水解产物是氨基酸 | |
| C. | 油脂主要在小肠中被消化吸收 | |
| D. | 脂肪中多不饱和酸含量越高,其营养价值也越高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com