
【题目】MgH2和Mg2Cu可用作贮氢材料,MgO可用作炉膛内脱硫脱硝的试剂。
(1)MgH2是一种离子化合物,其电子式为_______________。
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,该反应的化学方程式为_____________。
(3)已知MgH2的有关热化学方程式如下:
MgH2(s) =Mg(s)+H2(g) △H1=+74.4kJ mol-1;
H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ mol-1;
Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 KJ mol-1。
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为______________。
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为__________________。

(4)炉膛内脱除 SO2、NO 反应为2MgO(s)+2SO2(g)+2NO(g)![]() 2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
2MgSO4(s)+N2(g) △H =akJ/ mol,其平衡常数与温度的关系如图乙所示。
①上述反应的平衡常数表达式为K=_________。
②a_________0(填“>”或“,<”)。
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为_________。充电时,Y极的电极反应式为______________。
【答案】 [H:]- Mg2+[:H]- 2Mg2Cu+3H2=MgCu2+3MgH2 MgH2(s)+O2(g)=MgO(s)+H2O(g) △H=-309 kJ·mol-1 T3<T2<T1 ![]() < MgH2+2Li++2e-=Mg+2LiH Li++e-=Li
< MgH2+2Li++2e-=Mg+2LiH Li++e-=Li
【解析】(1)MgH2是一种离子化合物,其电子式为[H:]- Mg2+[:H]-,故答案为:[H:]- Mg2+[:H]-;
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,反应的化学方程式为2Mg2Cu+3H2= MgCu2+3MgH2,故答案为:2Mg2Cu+3H2=MgCu2+3MgH2;
(3)①根据①MgH2(s)=Mg(s)+H2(g) △H1=+74.4kJ mol-1;
②H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ mol-1;
③Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 KJ mol-1。
将①+②+③得:MgH2(s)+O2(g)=MgO(s)+H2O(g) △H=(+74.4kJ mol-1)+(-241.8 kJ mol-1)+(-141.6 KJ mol-1)=-309 kJ·mol-1,故答案为:MgH2(s)+O2(g)=MgO(s)+H2O(g) △H=-309 kJ·mol-1;
②温度越高,放出氢气的速率越快,温度由小到大的顺序为T3<T2<T1,故答案为:T3<T2<T1;
(4)①反应2MgO(s)+2SO2(g)+2NO(g)![]() 2MgSO4(s)+N2(g)的平衡常数表达式为K=
2MgSO4(s)+N2(g)的平衡常数表达式为K=![]() ,故答案为:
,故答案为:![]() ;
;
②根据图像,升高温度,平衡常数减小,说明平衡逆向移动,说明正反应为放热反应,a<0,故答案为:<;
(5)根据图像,固态锂为负极,X极为正极,结合放电时的电池反应2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为MgH2+2Li++2e-=Mg+2LiH。充电时,Y极为阴极,电极反应式为Li++e-=Li,故答案为:MgH2+2Li++2e-=Mg+2LiH;Li++e-=Li。


科目:高中化学 来源: 题型:
【题目】下图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:
①N2+3H2![]() 2NH3;②N2+O2
2NH3;②N2+O2![]() 2NO
2NO
根据图中的数据判断下列说法正确的是 ( )
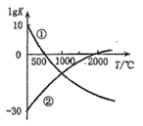
A.只有反应①是放热反应
B.升温,反应①的速率减小反应②的速率增大
C.可以在常温下利用反应①进行工业固氮
D.曲线的交点表示反应①和反应②体系中 N2 的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃、101 kPa 下:①2Na(s)+![]() O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1
O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s)ΔH2=-511 kJ·mol-1下列说法正确的是 ( )
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)=2Na2O(s) ΔH=-317 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的说法正确的是
A. 原电池将化学能转变为电能
B. 原电池将电能转变为化学能
C. 中和反应放热说明中和反应前后能量不守恒
D. 吸热反应中生成物的总能量低于反应物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为6种短周期主族元素,其原子序数依次增大。A、C可形成A2C和A2C2两种化合物,B的最高正化合价与最低负化合价的绝对值之差为2,D和A同主族,E是地壳中含量最高的金属元素,F和C同主族且可形成FC2和FC3两种化合物。
(1)G的元素名称是__________,在元素周期表中的位置是__________。
(2)C、D、E、F简单离子的半径由大到小的顺序是__________(填离子符号)。
(3)工业上冶炼E的单质反应的化学方程式是__________。
(4)由上述6种元素中的4种元素组成的化合物X,X既能与热的NaOH溶液反应,也能与稀盐酸反应,且均能生成无色气体,X的化学式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】压强对化学反应速率的影响针对的是( )的反应
A. 一切化学反应 B. 有固体参加或有固体生成的反应
C. 有气体参加或有气体生成的反应 D. 有液体参加或有液体生成的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g)+B(g) ![]() xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x=
(2)从反应开始到10s,B的平均反应速率为
(3)从反应开始到40s达平衡状态,A的平均反应速率为
(4)平衡时容器中B的体积分数为
(5)该温度下此反应的平衡常数表达式为 数值是
(6)下列各项能表示该反应达到平衡状态是
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量 n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关除杂方法正确的是( )
A.除去Fe3+中Al3+:加入过量氨水充分反应后,过滤
B.除去FeCl3 中少量CuCl2:用足量的铁粉,过滤
C.除去石英中的碳酸钙:用足量稀盐酸溶解后,过滤
D.除去铝粉中的镁粉:加入足量的氢氧化钠溶液后,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃某溶液中c(OH-)=1×10-14 mol·L-1,满足此条件的溶液可能是( )溶液
A. 酸性 B. 碱性 C. 酸性或碱性 D. 中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com