
| A. | 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 向石灰水中加入过量小办打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | 向Ca(ClO)2中通放少量CO2:2ClO -+CO2+H2O=2HClO+CO32- | |
| D. | 用稀硝酸除去试管内壁的银镜:Ag+NO3-+2H+=Ag++NO2↑+H2O |
分析 A.硫酸氢钠与氢氧化钡按照物质的量之比2:1反应,恰好呈中性;
B.碳酸氢钠过量,反应生成碳酸钙、碳酸钠和水;
C.二者反应生成次氯酸和碳酸钙;
D.不符合反应客观事实.
解答 解:A.硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性时发生反应的离子反应方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故A正确;
B.向石灰水中加入过量小办打溶液,离子方程式:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-,故B错误;
向Ca(ClO)2中通放少量CO2时发生反应的离子反应方程式为Ca2++2ClO -+CO2+H2O=2HClO+CaCO3↓,故C错误;
D.用稀硝酸除去试管内壁的银镜,离子方程式:3Ag+NO3-+4H+=Ag++NO↑+2H2O,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,熟悉离子反应方程式书写方法反应实质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
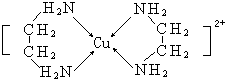
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g CH4中含有的原子总数为5NA | |
| B. | 78g苯含有碳碳双键的数目为3NA | |
| C. | 1mol/L NaCl溶液中含有的氯离子数目为NA | |
| D. | 标准状态下,11.2L CH3COOH中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
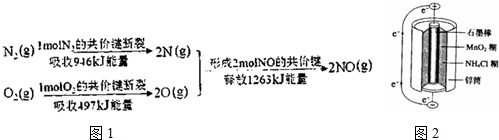
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 水分子间存在π键 | B. | 水分子间存在氢键 | ||
| C. | 水分子是V形结构 | D. | 水分子是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
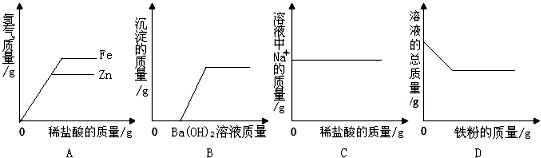
| A. | 将等质量的锌片和铁片分别加入足量的等质量等质量分数的稀盐酸中 | |
| B. | 向盐酸与硫酸钠混合溶液中加入氢氧化钡溶液 | |
| C. | 向一定量的氢氧化钠溶液中滴加稀盐酸 | |
| D. | 向一定量的硫酸铜溶液中加入铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
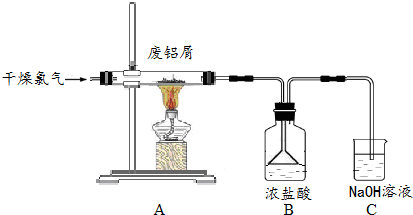
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com