
 ②Cl2
②Cl2 ③CO2
③CO2 ④H2O2
④H2O2 ⑤HClO
⑤HClO ⑥HCN
⑥HCN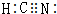
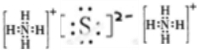 ⑧Ca(OH)2
⑧Ca(OH)2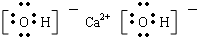 ⑨N2H4
⑨N2H4 ⑩CO(NH2)2
⑩CO(NH2)2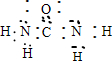 .
. 分析 ①氮气中存在3对共用电子对,氮原子最外层达到8个电子;
②氯气中存在1对氯氯共用电子对,氯原子最外层达到8电子稳定结构;
③二氧化碳中存在两个碳氧双键,C、O原子最外层都达到最外层8个电子;
④双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
⑤HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键;
⑥HCN的结构式为H-C≡N,将短线转化为共用电子对,且N原子含有1对孤电子对;
⑦硫化铵为离子化合物,两个铵根离子与硫离子通过离子键结合;
⑧Ca(OH)2是离子化合物,由由Ca2+离子和OH-离子构成;
⑨肼是氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键;
⑩CO(NH2)2为共价化合物,C原子与氧原子共用2对电子,与两个氮原子各共用1对电子.
解答 解:①氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ;
;
故答案为: ;
;
②Cl2的电子式为: ,
,
故答案为: ;
;
③二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,
,
故答案为: .
.
④双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ;
;
故答案为: ;
;
⑤HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ;
;
故答案为: ;
;
⑥HCN的结构式为H-C≡N,将短线转化为共用电子对,且N原子含有1对孤电子对,HCN的电子式为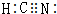 ,
,
故答案为: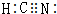 ;
;
⑦硫化铵为离子化合物,两个铵根离子与硫离子通过离子键结合,电子式为: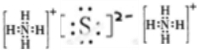 ;
;
故答案为: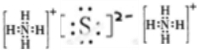 ;
;
⑧Ca(OH)2是离子化合物,由由Ca2+离子和OH-离子构成,Ca(OH)2的电子式为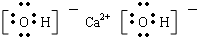 ;
;
故答案为: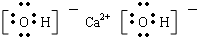 ;
;
⑨肼是氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,电子式为
故答案为:
⑩CO(NH2)2为共价化合物,C原子与氧原子共用2对电子,与两个氮原子各共用1对电子,电子式: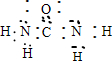 ;
;
故答案为: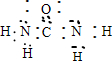 .
.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| B. | 沼气的利用,玉米制乙醇都涉及生物质能的利用 | |
| C. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| D. | pH计可用于酸碱中和滴定终点和乙酸乙酯的水解程度的判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶在装待测液前要用待测液润洗2~3次 | |
| B. | 用25mL酸式滴定管量取20.00mLKMnO4溶液 | |
| C. | 测某溶液pH:用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测 | |
| D. | 加热蒸发NaHCO3溶液得纯净的NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从C(石墨)=C(金刚石)△H=+1.9 kJ•mol-1,可知金刚石比石墨更稳定 | |
| B. | 相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ | 0 |
| KMnO4酸性溶液的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
| 实验编号 | 20℃下,试管中所加试剂及其用量/mL | 20℃下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | V2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电解制备磷酸亚铁锂的过程中,阳极的电极反应式为:Fe+H2PO4-+Li+-2e-═LiFePO4+2H+ | |
| B. | 放电过程中Li+向负极移动,充电过程中Li+向阴极移动 | |
| C. | 充电时,LiFePO4既发生氧化反应又发生还原反应 | |
| D. | 该锂电池放电时正极反应式为FePO4+Li++e-═LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
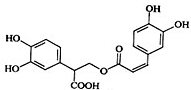 迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和含6mol Br 2 的浓溴水反应 | |
| C. | 迷迭香酸可以发生水解反应、取代反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com