
| A. | A与B具有相同的电子层数 | |
| B. | A的金属活动性顺序排在Zn之后 | |
| C. | A与B能生成A2B3型固态化合物 | |
| D. | A元素的单质与B元素单质反应时,每消耗9 g A的同时消耗16g B |
分析 设A、B的质子数分别为x、y,则①x+y=21,质子数与核电荷数相等,则②x-y=5,联立①②计算出A、B的核电荷数,结合元素周期律知识进行判断.
解答 解:元素的质子数与核电荷数相等,设A、B的质子数分别为x、y,
则①x+y=21,②x-y=5,
联立①②解得:x=13,y=8,
所以A为Al元素、B为O元素,
A.Al位于第三周期,O位于第二周期,二者含有的电子层数不同,故A错误;
B.A为Al,铝的活泼性大于锌,排在Zn的前面,故B错误;
C.Al与O反应生成Al2O3固体,故C正确;
D.铝与氧气反应生成Al2O3,9g铝的物质的量为:$\frac{9g}{27g/mol}$=$\frac{1}{3}$mol,消耗氧气的质量为:$\frac{1}{3}$mol×$\frac{3}{2}$×16g/mol=8g,故D错误;
故选C.
点评 本题考查了原子结构与元素性质,题目难度不大,根据题干数据正确判断A、B为解答关键,注意熟练掌握常见元素及其化合物性质,试题培养了学生的灵活应用能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 合成氨工厂采用增大压强以提高原料的转化率 | |
| B. | 实验室用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶有气泡从溶液中冒出 | |
| D. | 2NO2(g)═N2O4(g)的平衡体系中,加压缩小体积后颜色加深用来表示可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于2amol•L-1 | B. | 等于2amol•L-1 | C. | 小于2amol•L-1 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
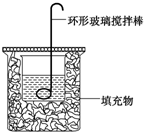 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 +NaOH→
+NaOH→ +
+
 +HCl→
+HCl→

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验试剂及用量 | 溶液温度 | |||
| t1 | t2 | |||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ |
| ③ | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 24.5℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com