
【题目】既可用排水法又可用排空气法收集的气体是
A.H2B.HClC.NO2D.N2
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】NO2是形成雾霾天气的原因之一。
(1)重型车辆常在排气管内喷淋尿素[CO(NH2)2]溶液,使NO2转化为无污染物质。采用“喷淋”的目的是 ,反应的活化能 (选填“增大”“减小”“不变”),写出该反应的化学方程式: 。【已知:CO(NH2)2中N呈-3价】
(2)以CO2与NH3为原料可合成化肥尿素。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ·mol-1
②NH2CO2NH4(s) =CO(NH2)2(s)+H2O(l) ΔH=-160.5 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
写出CO2与NH3合成尿素和气态水的热化学反应方程式 。
(3)恒温下将1.6 mol NH3和0.8 mol CO2放入容积为8 L的恒容密闭容器中,反应生成NH2CO2NH4(s),下列各项能说明反应达到平衡状态的是 。
a.容器内气体压强保持不变 b.CO2与NH3的速率之比为1∶2
c.NH2CO2NH4(s)质量保持不变 d.容器内温度保持不变
该反应达到平衡时,测得CO2的物质的量浓度为0.05 mol·L-1。则平衡时CO2的转化率α= ;若其他条件不变,移去少量NH2CO2NH4,CO2的转化率 (选填“增大”“减小”“不变”)。

(4)为减少NO2排放,可将NO2转化为NO后通入如右图所示装置,同时补充气体物质A使NO全部转化为NH4NO3,该装置中总化学反应方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化钡是分析化学中的重要试剂。工业上以重晶石矿(主要成分BaSO4,含杂质Fe2O3、SiO2)为原料,生产Ba(OH)2·8H2O的流程示意如下:

已知:高温焙烧,炭还原重晶石的反应方程式为:BaSO4+4C![]() CO↑+BaS
CO↑+BaS
(1)氢氧化钡的电子式为___________。
(2)水浸并过滤后的滤渣中含三种单质,分别为C、______和____ (填化学式),滤液1显______(填“酸性”或“碱性”)。向滤液1中加入CuO后,会生成黑色沉淀,该反应的化学方程式为___________。
(3)还可采用如下流程对滤液1进行处理:

若D物质为AB型,其组成与MnO2相同,滤液1中加入MnO2的化学方程式为_______。该方法的优点是_____。
(4)由滤液2得到产品需采用的操作是___________、___________、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是
A. Na2S 溶液中 c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S)
B. Na2CO3溶液中:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)
C. 室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合,溶液中离子浓度的大小顺序:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. pH=4的0.1molL﹣1NaHC2O4溶液中c(H C2O4﹣)>c(H+)>c(H2C2O4)>c(C2O42﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含有6.02×1023个H的H2O,其物质的量是________ mol;含有0.4 molAl3+的Al2(SO4)3溶液中所含SO42-的个数是________
(2)0.3 mol NH3分子中所含原子数与_______ molH2O分子中所含原子数相等。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(4)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该化合物加热至结晶水全部失去,剩余的残渣为b g,则n=________。
(5)在同温同压下,某气体X与H2气体的密度之比为14:1,则气体X的分子式可以是_______________(至少写出两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料。利用CO2和H2在催化剂的作用下合成甲醇,主要发生的反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) H1=-53.7 kJmol-1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) H2=+41.2 kJmol-1
(1)已知化学键的键能如下:

①反应Ⅲ:CO(g)+ 2H2(g) CH3OH(g) H3=_____________。
②碳氧双键的键能为__________________。
③在某一条件下,上述反应同时发生,若反应I、Ⅱ、III的化学平衡常数分别为K1、K2、K3,则K2=____________________(用含K1、K3的形式表示)。
(2)研究表明,在催化剂存在下,CO2和H2可发生反应I和Ⅱ。某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据(甲醇选择性即转化的CO2中生成甲醇的百分数):
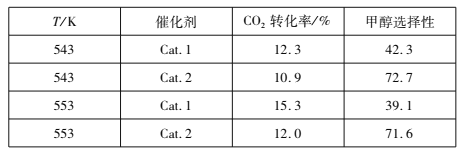
①543 K时,使用催化剂Cat.2,测得实验数据时反应I所处的状态为________________(填:“正向进行”、“平衡状态”、“逆向进行”)。
②有利于提高反应I中H2平衡转化率的措施是___________(填标号)。
A.使用催化剂Cat.1 B.降低反应温度
C.投料比不变,增加反应物的浓度 D.减小CO2和H2的初始投料比

(3)在上述反应中,混合气体CO、CO2和H2的组成关系为n(H2)/n(CO+ CO2)=2.60时,体系中的CO平衡转化率α(CO)与温度和压强的关系如图所示:
①图中的压强由大到小的顺序为____________。
②α(CO)值随温度升高而变小的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
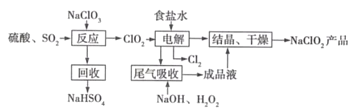
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com