
1 1 |
2 1 |
13 6 |
14 6 |
14 7 |
56 26 |
56 26 |
16 8 |
16 8 |
1 1 |
2 1 |
3 1 |
A Z |
n b |
16 8 |
16 8 |
1 1 |
2 1 |
3 1 |
16 8 |
16 8 |
16 8 |
16 8 |
1 1 |
2 1 |
13 6 |
14 6 |
1 1 |
2 1 |
13 6 |
14 6 |
14 6 |
14 7 |
14 6 |
14 7 |
56 26 |
56 26 |
16 8 |
16 8 |
16 8 |
16 8 |


科目:高中化学 来源: 题型:
| 离子组 | 加入试剂 | 加入试剂后发生反应的例子方程式 | |
| A | Fe2+、NO3-、Ag- | 浓硫酸 | 3Fe2++NO3-+4H+═3Fe2++NO2↑+2H2O |
| B | Fe3+、I-、ClO- | KOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | Ba2+、HCO3-、Cl- | NaOH溶液 | HCO3-+OH-=CO32-+H2O |
| D | Ag+、F-、NO3- | 少量氨水 | Ag++NH3H2O═AgOH↓+NH4+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子数的2倍 |
| Y | Y原子基态时2p原子轨道上有3个未成对的电子 |
| Z | Z的基态原子最外层电子排布式为:nsnnpn+2 |
| W | W的原子序数为29 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
硫的氧化物、氮的氧化物和一氧化碳是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| B、12.5 mL 16 mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、10 L pH=1的硫酸溶液中含有的H+数为2NA |
D、0.5 mol雄黄(As4S4,结构如右图)含有NA个S-S键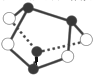 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在足量硝酸中,〔Cu(NH3)4〕2+、Cl-、Na+、Br- | ||
| B、能使碘化钾淀粉试纸变蓝的溶液中,K+、Fe2+、SO42-、Cl- | ||
C、常温下,c(H+)=
| ||
| D、c(OH-)/c(H+)=1×10-12的溶液,NH4+、Mg2+、Cl-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com