
 为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.| 实验序号 | 温度℃ | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
分析 (1)利用图表数据结合化学三行计算,反应速率v=$\frac{△c}{△t}$,计算此时的平衡常数和浓度商比较平淡反应进行的方向;
(2)实验2和实验1相比,起始量相同,升温平衡向吸热反应方向进行,反应是放热反应,则升温平衡逆向进行,反应物转化率减小;
(3)依据(1)计算的平衡常数结合化学平衡三行计算列式计算,
(4)已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在100℃条件下,是气体,CCl4+H2?CHCl3+HCl△H<O,反应是气体体积不变的放热反应,当正逆反应速率相同时反应达到平衡状态,各组分含量保持不变,据此分析选项;
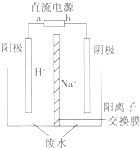
(5)①据电解池的阴阳极可知,a为燃料电池的正极,氧气在正极反应,b为负极,甲醚在负极反应,b极为负极,通入甲醚;a极为正极,正极反应为:13O2+52e-=26O2-;
②不能用铜作阳极,铜做阳极时铜失电子为铜离子,铜离子不能与+6价铬发生氧化还原反应反应得到+3价铬;
③在酸性条件下,亚铁离子将+6价的Cr还原为+3价的Cr,离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;
解答 解:(1)实验Ⅰ依据图表数据列式计算,CCl4+消耗量=0.8×60%=0.48
CCl4+H2?CHCl3+HCl
起始量(mol/L) 1 1 0 0
变化量(mol/L) 0.6 0.6 0.6 0.6
平衡量(mol/L) 0.4 0.4 0.6 0.6
10h后反应达到平衡,则从反应开始至达到平衡状态,H2的平均反应速率V=$\frac{0.6mol/L}{10h}$=0.06mol/L•h,
K=$\frac{0.6×0.6}{0.4×0.4}$=$\frac{9}{4}$=2.25,反应前后气体物质的量不变,可以用物质的量代替浓度计算,设条件为1L,
Q=$\frac{0.6×(0.6+0.5)}{(0.4+0.5)×0.4}$=$\frac{11}{6}$=1.83<K=2.25,反应正向进行,平衡向右移动,
故答案为:向右移动;
(2)实验2和实验1相比,起始量相同,升温平衡向吸热反应方向进行,反应是放热反应,则升温平衡逆向进行,反应物转化率减小,x>50%,选B,
故答案为:B;
(1)实验3和实验1温度相同,平衡常数相同,结合平衡三行计算列式计算,
CCl4+H2 ?CHCl3+HCl
起始量(mol/L) 0.8 y 0 0
变化量(mol/L) 0.48 0.48 0.48 0.48
平衡量(mol/L) 0.32 y-0.48 0.48 0.48
K=$\frac{0.48×0.48}{0.32(y-0.48)}$=$\frac{9}{4}$
y=0.8
故答案为:0.8;
(4)已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在100℃条件下,是气体,CCl4+H2?CHCl3+HCl△H<O,反应是气体体积不变的放热反应,
A.反应前后气体体积不变,压强始终不变化,不能说明反应达到平衡状态,故A错误;
B.生成HCl的速率和消耗H2的速率相等只能说明反应正向进行,不能说明反应达到平衡状态,故B错误;
C.反应前后气体质量和体积不变,混合气体的密度始终不变,不能说明反应达到平衡状态,故C错误;
D.H2的质量不再变化,说明氢气浓度不变是平衡标志,故D正确;
故答案为:D.
(5)①据电解池的阴阳极可知,a为燃料电池的正极,氧气在正极反应,b为负极,甲醚在负极反应,b极为负极,通入甲醚;a极为正极,正极反应为:13O2+52e-=26O2-,
故答案为:甲醚,13O2+52e-=26O2-;
②不能用铜作电解重铬酸钠废水的电极,铜做阳极时铜失电子为铜离子,铜离子不能与+6价铬发生氧化还原反应反应得到+3价铬,
故答案为:不能;铜做阳极时铜失电子为铜离子,铜离子不能与+6价铬发生氧化还原反应反应得到+3价铬;
③在酸性条件下,亚铁离子将+6价的Cr还原为+3价的Cr,离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
点评 本题考查了化学平衡的影响因素分析、化学平衡的计算应用、燃料电池的反应原理以及电解池的相关知识,题目难度中等,注意电极反应式的书写.


科目:高中化学 来源: 题型:解答题
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的导电性介于金属和绝缘体之间,是良好的半导体 | |
| B. | 加热到一定温度时,硅能与氯气、氧气等非金属反应 | |
| C. | 利用二氧化硅与C反应能制得粗硅 | |
| D. | 二氧化硅性质较稳定,常温下不与任何物质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.
天津8.12爆炸事件中,港口保存有NaCN等剧毒物品.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
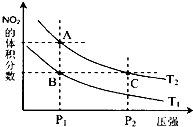 对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是bc.
对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是bc.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com