
【题目】下列各组离子在无色酸性溶液中可以大量共存的有( )
A.Ag+、K+、NO3﹣、Cl ﹣
B.K+、Cu2+、SO42﹣、HCO3﹣
C.Mg2+、Cl﹣、SO42﹣、Na+
D.CO32﹣、K+、NO3﹣、Na+
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】中国有句古语:“一方水土养一方人”,饮水是提供人体必需的矿物质和微量元素重要途径之一。在天然无污染的泉水中,含有Cu、K、Ca、Zn、P、Mg、Na、Fe等人体必需元素,其中属于大量元素的是
A. Cu、K、Ca、ZnB. K、Ca、P、MgC. P、Cu、Na、FeD. Ca、Zn、P、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,分别向10 mL浓度均为0.1mol/L的CuCl2和ZnCl2溶液中滴加0.1mol/L的Na2S 溶液,滴加过程中溶液中-1gc(Cu2+)和-lgc(Zn2+)与Na2S 溶液体积(V)的关系如图所示。(已知: Ksp(ZnS) > Ksp(CuS),1g3≈0.5) 下列有关说法错误的是
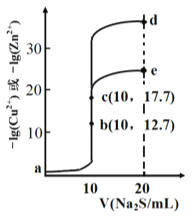
A. 溶液pH:a<b<e B. a 点的ZnCl2 溶液中: c(Cl-)<2[c(Zn2+)+c(H+)]
C. a-b-e为滴定CuCl2溶液的曲线 D. d点纵坐标小于34.9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲和乙为中学化学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色。试回答下列问题:
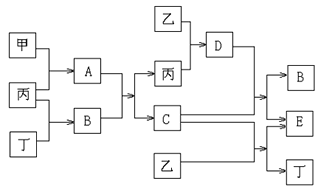
(1)A和E的化学式分别为_____________、____________;
(2)A+B→C+丙的化学方程式:__________________________________________ ;
(3)D+C→B+E的化学方程式:__________________________________________ ;
(4)1mol甲和1mol乙混合投入到足量的B中,在标准状况下,最多能产生丁气体______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民经济中占有重要地位。完成合成氨工业中有关问题。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①高温高压、催化剂条件下,工业合成氨的热化学方程式为:____________________________________________。
②若起始时向容器内放入0.2 mol N2和0.6 mol H2,达到平衡后放出的热量为Q,则Q值______18.44 kJ(填“﹥”“=”或“﹤”)。
(2)NH3(g)与CO2(g) 经过两步反应合成尿素(CO(NH2)2),两步反应的能量变化示意图如下:
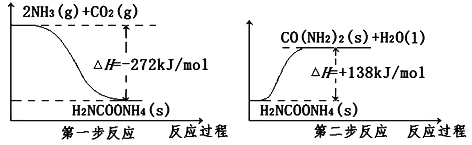
①则2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
CO(NH2)2(s)+H2O(l) ΔH=_________kJ/mol。
②在一定温度和压强下,若①中的反应,NH3和CO2的物质的量之比(氨碳比)n(NH3)/n(CO2)=x。下图是氨碳比(x)与CO2平衡转化率(α)的关系。

α随着x增大而增大的原因是_________________________________。
③图中B点处,NH3的平衡转化率_______________。
(3)将N2和H2各1 mol充入一密闭容器中,在一定条件下发生合成氨反应。反应至平衡的过程中,N2的体积分数将_______________(填序号)。
a.一直减小 b.始终不变 c.一直增大 d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)①H2 + CuO ![]() Cu + H2O
Cu + H2O
②CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
③3S + 6NaOH ![]() 2Na2S + Na2SO3 + 3H2O
2Na2S + Na2SO3 + 3H2O
④NH4NO3 + Zn = ZnO + N2↑+ 2H2O
⑤Cu2O + 4HCl = 2HCuCl2 + H2O
上述反应中,属于氧化还原反应的是__________________________(填序号)
(2)SeO2、KI和HNO3可发生反应:SeO2+KI+HNO3→Se+I2+KNO3+H2O,配平该反应的化学方程式并用双线桥法标出电子转移的方向和数目:____________________________。
(3)在反应 KIO3 + 6HI = 3I2 + KI + 3H2O中,氧化剂与还原剂的物质的量之比为__________。
Ⅱ.已知:
① 2H2O + Cl2 + SO2 = H2SO4 + 2HCl ② 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
(4)根据以上两个反应可以得出氧化剂和还原剂的强弱顺序,请写出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 这六种物质组成的氧化还原反应的方程式并配平:_______________________。
在反应②中,若有18.25g HCl被氧化,求:
(5)转移的电子数为:_______________。
(6)标况下生成Cl2的体积(请列式计算)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。

已知:在溶液中.FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
A. 装置F、I中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 装置J收集的气体中一定不含NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com