
| A. | 热稳定性:HCl>H2S>PH3 | B. | 酸性强弱:H4SiO4<H2CO3<HNO3 | ||
| C. | 金属性:Na<Mg<Al | D. | 沸点:H2O>H2S |
分析 A.非金属性越强,则气态氢化物越稳定;
B.非金属性越强,对应最高价氧化物的水化物的酸性越强;
C.同一周期,随着原子序数的增大,金属性减弱;
D.分子晶体的熔点取决于相对分子质量和氢键,含有氢键的熔沸点高.
解答 解:A.由于非金属性Cl>S>P,故氢化物的稳定性HCl>H2S>PH3,故A正确;
B.非金属性N>C>Si,对应最高价氧化物的水化物的酸性为H4SiO4<H2CO3<HNO3,故B正确;
C.由于三者处于同一周期,且原子序数Na<Mg<Al,故金属性Na>Mg>Al,故C错误;
D.由于水中存在氢键,所以水的沸点高于硫化氢,故D正确,
故选C.
点评 本题考查元素周期表和元素周期律,熟悉金属性、非金属性的比较方法是解答本题的关键,难度不大,注意规律性知识的总结.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | NH3分子中氮原子的轨道杂化方式为sp3杂化 | |
| B. | [Cu(NH3)4]2+中,NH3分子是配体 | |
| C. | NH4+与PH4+、CH4、BH4-互为等电子体 | |
| D. | 相同压强下,NH3沸点比PH3的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
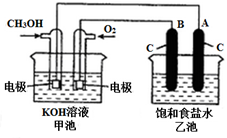 甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
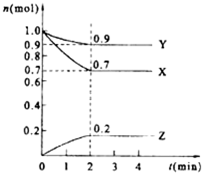 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示. 2Z;
2Z;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
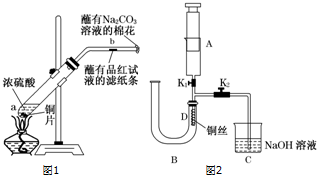
 某研究性学习小组设计了一组实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他们设计了如图装置以验证 氮、碳、硅元素的非金属性强弱.他们设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.
某研究性学习小组设计了一组实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他们设计了如图装置以验证 氮、碳、硅元素的非金属性强弱.他们设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
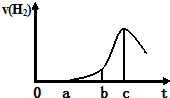 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | v1 | v2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | v3 |
| 水的体积/mL | 15 | 14.5 | v4 | 13.5 |
| 所需时间/min | t1 | t2 | t3 | t4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com