
【题目】今年是门捷列夫发现元素周期律 150 周年。下表是元素周期表的一部分,W、X、Y、Z 为短周期主族元素,W 原子最外层电子数是其内层电子数的 3 倍。下列说法正确的是( )
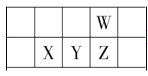
A.原子半径:W>X
B.最高价氧化物的水化物酸性:Y>Z
C.气态氢化物沸点:Z>W
D.气态氢化物热稳定性:Z<W
【答案】D
【解析】
W原子最外层电子数是其内层电子数的3倍,根据核外电子排布规律,即W为O,根据四种元素在周期表位置,推出四种元素,然后据此分析;
W原子最外层电子数是其内层电子数的3倍,根据核外电子排布规律,即W为O,根据四种元素在周期表位置,X为Si,Y为P,Z为S,
A、同主族从上到下原子半径增大,即r(O)<r(S),故A错误;
B、两种元素最高价氧化物对应的水化物分别是H3PO4、H2SO4,酸性强弱:H2SO4>H3PO4,故B错误;
C、两种元素的氢化物是H2O和H2S,H2O分子间存在氢键,其沸点比没有分子间氢键的H2S高,故C错误;
D、O的非金属性强于S,即H2O比H2S稳定,故D正确;
答案为D。


科目:高中化学 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,应用这一反应,下列所给化合物中可以与钠合成环丁烷的是
A. CH2BrB. CH2BrCH2CH2CH2Br
C. CH2BrCH2CH2BrD. CH3CH2CH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是
A. 碳酸的电离方程式:H2CO32H++CO32-
B. 碱性氢氧燃料电池负极的电极反应式:H2—2e-=2H+
C. 向FeBr2溶液中通入少量Cl2:2Br-+ Cl2= Br2+2Cl-
D. 如图所示,反应开始时的离子方程式:Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1.0mol·L -1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积(V)关系如右图所示,则原硫酸溶液的物质的量浓度和恰好完全反应后溶液的总体积分别是(设二者混合后体积为二者体积之和)
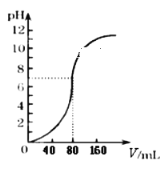
A. 0.5mol·L-1 80mLB. 0.5mol·L-1 160mL
C. 1.0mol·L-1 80mLD. 1.0mol·L-1 160mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示的四种实验操作名称从左到右依次是( )

A.过滤、蒸发、蒸馏、分液B.过滤、蒸馏、蒸发、分液
C.蒸发、蒸馏、过滤、分液D.分液、蒸馏、蒸发、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)氮化钙是一种棕色粉末,在空气中氧化,遇水会发生水解,生成氢氧化钙并放出氨。某化学兴趣小组设计制备氮化钙的实验如下:
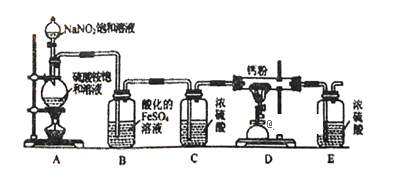
Ⅰ.氮化钙的制备
(1)连接装置后,检查整套装置气密性的方法是_______________________________________。
(2)装置A中每生成标准状况下4.48LN2,转移的电子数为___________________。
(3)装置B的作用是吸收氧气,则B中发生反应的离子方程式为______________________。装置E的作用是______________________。
(4)实验步骤如下:检查装置气密性后,装入药品;_____________________(请按正确的顺序填入下列步骤的代号)。
①点燃D处的酒精喷灯; ②打开分液漏斗活塞; ③点燃A处的酒精灯; ④停上点燃A处的酒精灯;⑤停止点燃D处的酒精喷灯
(5)请用化学方法确定氮化钙中含有未反应的钙,写出实验操作及现象_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i.2NO(g)+Cl2(g)2ClNO(g) △H 1<0 其平衡常数为K1
ii.2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3=_______(用K1、K2表示),反应热△H3=__________(用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:
①10min内υ(ClNO)=_________ ,平衡常数K2=___________;
②若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:α1(NO2)______α2(NO2)(填“>”“<”或“=”)。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是______________。
a.c(Na+)=c(HSO3-)+2c(SO32-)
b.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—)
c.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3)
d.c(OH-) +c(SO32-)=c(H2SO3)+c(H+)
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则
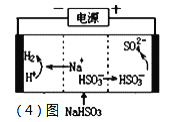
①工作一段时间后,阴极区溶液的pH______(填“增大”“减小”或“不变”);
②写出阳极的电极反应式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)有下列物质:①铜;②石灰水;③CO2;④Fe(OH)3溶液;⑤CaO;⑥豆浆。其中属于胶体的是_____(填序号,下同),属于碱性氧化物的是_____
(2)在标准状况下,35.5g氯气的体积是_____L.将其与氢气化合,需氢气的物质的量是_____mol,将生成的气体溶于水,配成500mL溶液,则该溶液中溶质的物质的量浓度是_____mol/L
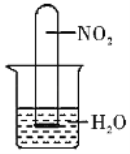
(3)如图所示,将充满NO2气体的试管倒扣在水槽中,观察到试管内气体颜色由_____色逐渐变为无色,最终试管内液面上升至试管容积的_____处(填分数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com