
分析 ①蛋白质主要存在于肉类、蛋类、豆类中;
②维生素C是一种水溶性维生素,又名抗坏血酸;
③根据碘元素对人体的作用分析,人体缺乏碘元素将导致甲状腺肿大,幼儿缺乏会造成智力损害;
④食品防腐剂是指保持食品原有的质量和食品营养价值为目的食品添加剂,它能抑制微生物的生长和繁殖,山梨酸钾是常用的防腐剂;
⑤胃酸的成分为盐酸,治疗胃酸过多则选择胃舒平,因氢氧化铝与酸反应可减少盐酸,同时生成氯化铝和水.
解答 解:①蛋白质主要存在于肉类、蛋类、豆类中,牛奶和豆浆中都含有大量的蛋白质,
故答案为:a;
②维生素C是一种水溶性维生素,又名抗坏血酸,
故答案为:b;
③人体缺乏碘元素将导致甲状腺肿大,幼儿缺乏会造成智力损害,碘被称为“智力元素”,
故答案为:b;
④a.辣椒红为天然色素,为着色剂,故不选; b.碳酸氢钠为抗酸药,故不选; c.山梨酸钾为常用防腐剂,故选;
故答案为:c;
⑤胃酸与氢氧化铝反应,反应生成氯化铝和水,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+═Al3++3H2O.
点评 本题考查了人体的主要营养物质和维生素、微量元素对人体的作用、添加剂、抗酸药的原理,题目难度不大,为化学与生活的基础知识,注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>D>A>B | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:Cn+>D(n+)->An+>B(n+)+ | D. | 单质还原性:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
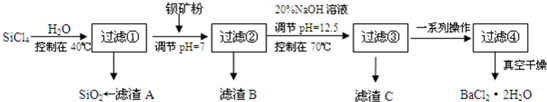
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol 过氧化钠中阴离子个数为2×6.02×1023 | |
| B. | 14g乙烯和丙烯的混合物中含有的碳原子的数目为6.02×1023 | |
| C. | 28g C16O与28g C18O中含有的质子数均为14×6.02×1023 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
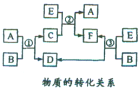 A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.| E的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(F的阴离子)/mol | 1.25 | 1.5 | 2 |
| n(C中的阴离子)/mol | 1.5 | 1.4 | y |
| n(B中的阴离子)/mol | x | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | N2(g)+3H2(g)?2NH3(g);△H=-Q1kJ/mol(Q1>0) | |
| B. | 2SO3(g)?2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-808.7 kJ/mol | |
| D. | 2CO(g)?C(s)+CO2(g);△H=-171.4kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com