
下列烷烃的名称是否正确?若不正确请改正。
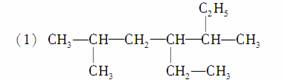
2甲基4,5二乙基己烷
________________________________________________________________________;
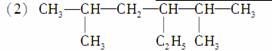
2,5二甲基4乙基己烷
________________________________________________________________________;
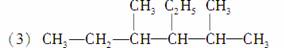
3乙基2,4二甲基己烷
________________________________________________________________________;
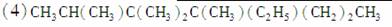
2,3,3,4,5五甲基4乙基己烷
________________________________________________________________________。
科目:高中化学 来源: 题型:
可以判断油脂皂化反应基本完成的现象是( )
A.反应液使红色石蕊试纸变蓝色
B.反应液使蓝色石蕊试纸变红色
C.反应后静置,反应液分为两层
D.反应后静置,反应液不分层
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式与苯丙氨酸(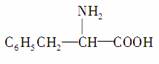 )相
)相
同,且同时符合下列两个条件:①有带两个取代基的苯环;②有一个硝基直接连接在苯环上。那么,这种物质的异构体的数目是( )
A.3种 B.5种
C.6种 D.10种
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C5H12O其中含有2个甲基的醇与分子式为C5H10O2的酸发生酯化反应得到的有机物可能的结构有(不包括立体异构)
A.24种 B.16种 C.12种 D.8种
查看答案和解析>>
科目:高中化学 来源: 题型:
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
①写出CO2与H2反应生成CH4和H2O的热化学方程式
已知: CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
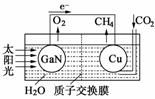
② 科学家用氮化镓材料与铜组装如右图的人工光合系统,
利用该装置成功地实现了以CO2和H2O合成CH4。
写出铜电极表面的电极反应式 。为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
③ 另一生成CH4的途径是CO(g)+3H2(g) CH4(g)+H2O(g)。某温度下,将0.1 mol CO和0.3 molH2充入10L的密闭容器内发生反应CO(g)+3H2(g)
CH4(g)+H2O(g)。某温度下,将0.1 mol CO和0.3 molH2充入10L的密闭容器内发生反应CO(g)+3H2(g)  CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K= 。(计算结果保留两位有效数字)
CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K= 。(计算结果保留两位有效数字)
天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入
空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)  2CO(g)+2H2(g) 。
2CO(g)+2H2(g) 。
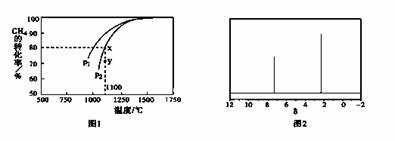
在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”
或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如下图2,则X的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某烷烃的结构简式为
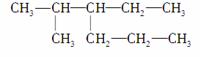 ,它的正确命名应是( )
,它的正确命名应是( )
A.2甲基3丙基戊烷 B.3异丙基己烷
C.2甲基3乙基己烷 D.5甲基4乙基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如图: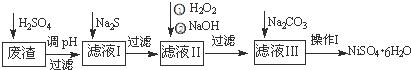
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式 :
(2)加6%的H2O2时,温度不能过高,其目的是
(3)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀.在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为
(4)上述流程中滤液Ⅲ的主要成分是
(5)操作Ⅰ包括以下过程:过滤,溶解, , ,洗涤获得NiSO4•6H2O晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O= 4Fe(OH)3↓+O2↑+8Na+ 则下列说法正确的是( )
A、该反应中 Fe2+是还原剂,O2 是还原产物
B、4molNa2O2 在反应中共得到 8NA 的电子
C、Fe(OH)3 既是氧化产物又是还原产物,每生成 4mol Fe(OH)3 反应过程中共转移电子 6mol
D、反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com