
目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。
【实验Ⅰ】 确定硫的质量:
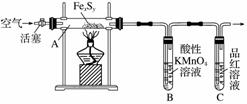
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0 g铁硫簇结构(含有部分不反应的杂质),在试管 B中加入50 mL 0.100 mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后,将B中溶液转移至 250 mL 容量瓶,洗涤试管B后定容。取25.00 mL该溶液用0.01 mol·L-1的草酸(H2C2O4)溶液滴定剩余的 KMnO4。记录数据如下:
| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
相关反应:①2MnO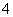 +2H2O+5SO2===2Mn2++5SO
+2H2O+5SO2===2Mn2++5SO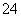 +4H+
+4H+
②2MnO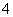 +6H++5H2C2O4===2Mn2++10CO2↑+8H2O
+6H++5H2C2O4===2Mn2++10CO2↑+8H2O
【实验Ⅱ】 确定铁的质量:
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6 g固体。
试回答下列问题:
(1)判断滴定终点的方法是____________________。
(2)试管C中品红溶液的作用是__________________________________________。
有同学提出,撤去C装置对实验没有影响,你的看法是________(选填“同意”或“不同意”),理由是____________________________。
(3)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为____________________。
【问题探究】 滴定过程中,细心的同学发现该KMnO4溶液颜色褪去的速率较平常滴定时要快得多。为研究速率加快的原因,该同学继续进行了下列实验,实验数据如下表:
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
(4)分析上述数据,滴定过程中反应速率加快的一种可能原因是________________________________________________________________________
________________________________________________________________________。
答案 (1)当滴入最后一滴草酸溶液时,锥形瓶中溶液由浅红色变为无色,且半分钟内不变化
(2)验证SO2是否被酸性KMnO4溶液完全吸收 同意
当B中溶液颜色不变化,即可证明SO2已被酸性KMnO4溶液完全吸收
(3)Fe3S4
(4)Mn2+对反应起到催化作用(或反应放热使温度升高),加快反应速率
解析 (3)第1次滴定时H2C2O4溶液体积误差较大,舍去,第2、3次取平均值,V(H2C2O4)=25.00 mL。与H2C2O4反应的KMnO4的物质的量为0.01 mol·L-1×0.025 L× =0.000 1 mol,与SO2反应的KMnO4的物质的量为 0.05 L×0.100 mol·L-1-10×0.000 1 mol=0.004 mol,n(SO2)=0.004 mol×
=0.000 1 mol,与SO2反应的KMnO4的物质的量为 0.05 L×0.100 mol·L-1-10×0.000 1 mol=0.004 mol,n(SO2)=0.004 mol×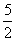 =0.01 mol,n(S)=0.01 mol;0.6 g 固体为Fe2O3,n(Fe)=
=0.01 mol,n(S)=0.01 mol;0.6 g 固体为Fe2O3,n(Fe)=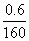 ×2 mol=0.007 5 mol,
×2 mol=0.007 5 mol, =
=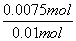 =
= ,所以该铁硫簇结构的化学式为Fe3S4。(4)对比实验1、2知,Mn2+可使反应速率加快;对比实验1、3知,温度升高,反应速率加快。
,所以该铁硫簇结构的化学式为Fe3S4。(4)对比实验1、2知,Mn2+可使反应速率加快;对比实验1、3知,温度升高,反应速率加快。


科目:高中化学 来源: 题型:
下列有关化学实验的叙述中,不正确的是( )
|
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 |
|
| B. | 制肥皂时,在皂化液里加入食盐,能够促进高级脂肪酸钠的析出 |
|
| C. | 制备乙酸乙酯时,为除去乙酸乙酯中的乙酸,用氢氧化钠溶液收集产物 |
|
| D. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
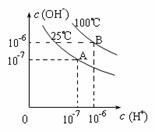
在不同温度下,水达到电离平衡时c(H+)与
c(OH—)的关系如右图所示,下列说法中正确的是
A、100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,
所得溶液的pH等于7
B、25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,
所得溶液的pH等于7
C、25℃时, 0.2 mol/L NaOH溶液与0.2 mol/L乙酸溶液恰好中和,所得溶液的pH等于7
D、25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液pH大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两容器,甲的容积固定,乙的容积可变。在一定温度下向甲中通入3molN2和4molH2,反应达到平衡时,生成NH3的物质的量为a mol。
(1)相同温度下,向乙中通入2molNH3,且保持容积与甲相同,当反应达到平衡时,各物质的浓度与甲中平衡时相同。起始时乙中通入____ molN2和_____ __molH2 。
(2)相同温度下,若乙中通入6 molN2和8molH2,且保持压强与甲相同,当反应达到平衡时,生成氨的物质的量为b mol,则a/b_____ ____1/2;若乙与甲的容积始终相等,达到平衡时,生成氨的物质的量为c mol,则a/c ____ _____1/2(填<、或>、或=)
查看答案和解析>>
科目:高中化学 来源: 题型:
0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
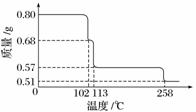
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式______________________________________;
(要求写出推断过程)。
(2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为________________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为________,其存在的最高温度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是 ( )
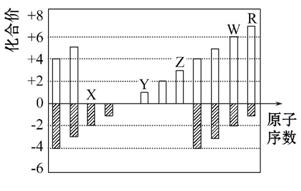
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物的是H2WO3
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:

观察1s轨道电子云示意图,判断下列说法正确的是( )
A.一个小黑点表示1个自由运动的电子
B.1s轨道的电子云形状为圆形的面
C.电子在1s轨道上运动像地球围绕太阳旋转
D.1s轨道电子云中点的疏密表示电子在某一位置出现机会的多少
查看答案和解析>>
科目:高中化学 来源: 题型:
普通泡沫灭火器的铁筒里装着一只小玻璃筒,玻璃筒内盛装硫酸铝溶液,铁筒里盛装碳酸氢钠饱和溶液。使用时,倒置灭水器,两种药液相混合就会喷出含二氧化碳的白色泡沫。
(1)产生此现象的化学方程式是
________________________________________________________________________
________________________________________________________________________。
不能把硫酸铝溶液装在铁筒里的主要原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
一般不用碳酸钠代替碳酸氢钠,是因为
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中加入A和B,各物质的物质的量浓度随着反
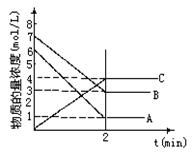
 应的进行,如右图所示。下列说法不正确的是
应的进行,如右图所示。下列说法不正确的是
A.该反应的化学方程式为5A+4B 4C
B.2min时,该反应达到平衡,此时A、B、C的浓度
比为5:4:4
C.用B的浓度变化表示2min内的速率为
2mol/(L·min)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com