
分析 ①根据中心原子形成的价层电子对判断杂化类型和分子的立体构型;
②H2SeO3的分子结构为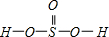 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为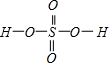 ,Se为+6价,后者Se原子吸电子能力强.
,Se为+6价,后者Se原子吸电子能力强.
解答 解:①同主族元素对应的氢化物中,元素的非金属性越强,对应的氢化物的酸性越弱,则H2Se的酸性比H2S强,
气态SeO3分子中Se形成3个δ键,没有孤电子对,为平面三角形分子,SO32-中S形成3个δ键,孤电子对数为$\frac{6+2-2×3}{2}$=1,则为三角锥形,
故答案为:强;平面三角形;三角锥形;
②H2SeO3的分子结构为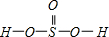 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为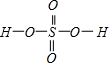 ,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
故答案为:H2SeO3和H2SeO4可表示为 (HO)SeO2和 (HO)2SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se-O-H中的O原子更向Se偏移,越易电离出H+.
点评 本题综合考查物质结构与性质相关知识,难度较大,需要学生具有扎实的基础与灵活运用的能力.


科目:高中化学 来源: 题型:选择题
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 在上述三步反应中理论上只有①生成②的反应原子利用率为100% | |
| B. | 氯化铁溶液和碳酸氢钠溶液都能鉴别①④ | |
| C. | ②③分子内含手性碳原子 | |
| D. | 在氢氧化钠溶液中,等物质的量的①和③分别消耗NaOH物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
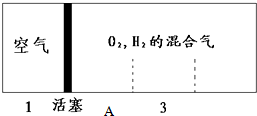 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央A处,则原来H2、O2的体积比最接近于7:2 或4:5;此比例的H2和O2混合气体的平均摩尔质量为8.67g/mol或18.67g/mol.
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央A处,则原来H2、O2的体积比最接近于7:2 或4:5;此比例的H2和O2混合气体的平均摩尔质量为8.67g/mol或18.67g/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡膳食就是各食物都要吃 | |
| B. | 摄入食物中的营养素种类齐全,数量充足,比例适当且与人体的需要的保持平衡才是合理的膳食结构 | |
| C. | 淀粉、油脂、蛋白质为人体提供热能,所以只要这三种摄入量足够就可 | |
| D. | 为维持人体内电解质平衡,人在大量出汗后应及时补充Ca2+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海洋中蕴含的元素有80多种,其中碘的储量可达8×1010t,所以碘被称为海洋元素 | |
| B. | 1774年瑞典科学家舍勒意外地发现一种黄绿色气体,并把它命名为氯气 | |
| C. | 19世纪科学家戴维首次用电解氯化钠溶液的方法制得金属钠 | |
| D. | 钠和钾的合金常温下是液体,可用于快中子反应堆的导热剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com