
分析 n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(HNO3)=0.4mol/L×0.1L=0.04mol,n(H2SO4)=0.1mol/L×0.1L=0.01mol,n(H+)=n(HNO3)+2n(H2SO4)=0.06mol,Cu和稀硝酸的离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,根据方程式知,如果0.03molCu完全反应需要氢离子的物质的量是0.08mol>0.06mol,所以氢离子不足量,应该以氢离子为标准计算;
(1)根据氢离子和NO之间的关系式计算NO体积;
(2)根据氢离子和铜离子之间的关系式计算铜离子浓度.
解答 解:n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(HNO3)=0.4mol/L×0.1L=0.04mol,n(H2SO4)=0.1mol/L×0.1L=0.01mol,n(H+)=n(HNO3)+2n(H2SO4)=0.06mol,Cu和稀硝酸的离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,根据方程式知,如果0.03molCu完全反应需要氢离子的物质的量是0.08mol>0.06mol,所以氢离子不足量,应该以氢离子为标准计算;
(1)设生成NO物质的量为x,
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
8mol 2mol
0.06mol x
8mol:2mol=0.06mol:x
x=$\frac{2mol×0.06mol}{8mol}$=0.015mol,
V(NO)=0.015mol×22.4L/mol=0.336L,
答:产生NO体积为0.336L;
(2)设生成铜离子物质的量是y,
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
8mol 3mol
0.06mol y
8mol:3mol=0.06mol:y
y=$\frac{3mol×0.06mol}{8}$=0.0225mol,
铜离子物质的量浓度=$\frac{0.0225mol}{0.1L}$=0.225mol/L,
答:铜离子浓度是0.225mol/L.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查分析计算能力,正确判断以哪种物质为标准进行计算是解本题关键,注意要进行过量计算,为易错题.


科目:高中化学 来源: 题型:选择题

| A. | X、Y、Z元素分别为N、P、O | |
| B. | 白格中都是主族元素,灰格中都是副族元素 | |
| C. | 原子半径:Z>X>Y | |
| D. | X、Y、Z的气态氢化物中最稳定的是:X的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al→Al2O3→Al(OH)3→NaAlO2 | B. | Si→SiO2→H2SiO3→Na2SiO3 | ||
| C. | N2→NO→NO2→HNO3 | D. | S→SO3→H2SO4→MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+Br2→BrCH2CH2Br | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 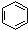 +HNO3$\stackrel{浓硫酸△}{→}$ +HNO3$\stackrel{浓硫酸△}{→}$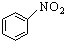 +H2O +H2O | |
| D. | C6H12O6$→_{△}^{催化剂}$2C2H5OH+2CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
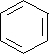 .
. .
.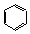 ;CH2=CH2和
;CH2=CH2和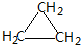 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器里的压强不随时间的变化而改变 | |
| B. | 单位时间内生成2mol HBr的同时,消耗1 mol H2 | |
| C. | 单位时间内生成2mol HBr的同时,生成1 mol H2 | |
| D. | 正反应和逆反应速率都相等,都等于0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com