
| A. | 24gNaH中阴离子所含电子总数为NA | |
| B. | 标准状况下,22.4L苯中含有C-H键数目为6NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为aNA/28 | |
| D. | 常温常压下,14.9 g KCl与NaClO的固体混合物中阴离子的数目为0.15 NA |
分析 A.求出NaH的物质的量,然后根据1molNaH中氢阴离子含2mol电子来分析;
B.标准状况下苯不是气体;
C.将CO2通过足量Na2O2中,过氧化钠增重的是CO的质量,结合化学方程式定量关系计算电子转移;
D.KCl与NaClO摩尔质量都为74.5g/mol,物质的量n=$\frac{m}{M}$,KCl与NaClO中都含一个阴离子.
解答 解:A.24gNaH的物质的量=$\frac{24g}{24g/mol}$=1mol,而1molH-中含2mol电子,即2NA个阴离子,故A错误;
B.标准状况下苯不是气体,22.4L苯物质的量不是1mol,故B错误;
C.将CO2通过足量Na2O2中,2Na2O2+2CO2=2Na2CO3+O2,固体增重的是CO的质量,即当1mol二氧化碳参与反应时,增重1molCO的质量即28g,故当固体质量增重28g时,参加反应的二氧化碳的物质的量为1mol,生成0.5molO2,氧元素化合价-1价变化为0价和+2价,电子转移总数为NA个,CO2通过Na2O2使其增重a g时,反应中转移的电子数为$\frac{a{N}_{A}}{28}$,故C正确;
D.KCl与NaClO摩尔质量都为74.5g/mol,物质的量n=$\frac{m}{M}$=$\frac{14.9g}{74.5g/mol}$=0.2mol,KCl与NaClO中都含一个阴离子,0.2mol固体混合物中阴离子的数目为0.12NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 水玻璃保存在用橡皮塞的玻璃试剂瓶中 | |
| B. | 氢氟酸保存在用橡皮塞的玻璃试剂瓶中 | |
| C. | 固体烧碱放在广口塑料瓶中并且塑料盖盖严 | |
| D. | 液溴密封盛放在棕色瓶中,液面放一层水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数X>Y | B. | 离子半径X>Y | ||
| C. | X和Y一定在同一周期 | D. | X是第IIA族元素,Y是第VIIA族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
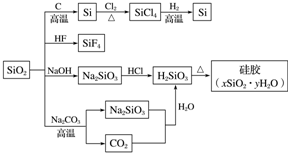
| A. | SiO2属于两性氧化物 | |
| B. | 盛放Na2CO3溶液的试剂瓶能用玻璃塞 | |
| C. | 图中所示转化反应都是氧化还原反应 | |
| D. | 硅胶吸水后可重复再生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2与2molNaHCO3固体混合物在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是NaOH和Na2CO3 | |
| B. | 由Na2O、Na2O2、Na2CO3•10H2O组成的混合物0.05 mol,溶于水后加入50 mL 2 mol/L的盐酸恰好完全反应,则原混合物中各成分的物质的量之比可以为任意值 | |
| C. | 向Na2 CO3饱和溶液中通入CO2,溶液变浑浊有晶体析出 | |
| D. | 将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是Na2O和Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2 O2 $\frac{\underline{\;点燃\;}}{\;}$ CO2+2H2O | |
| B. | CH2═CH2+H2→CH3-CH3 | |
| C. |  +Br2$\stackrel{FeBr_{2}}{→}$ +Br2$\stackrel{FeBr_{2}}{→}$ +HBr +HBr | |
| D. | 2CH3CH2OH+O2 $→_{△}^{Cu或Ag}$ 2CH3CHO+2 H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com