

分析 (1)减少生成物浓度平衡正向移动;
(2)根据元素守恒知,X为二氧化碳,实验室用澄清石灰水检验二氧化碳;
(3)Al和氯化铁发生氧化还原反应生成氯化铝和氯化亚铁;
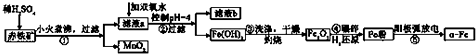
(4)铝土矿加入过量NaOH可将SiO2、Al2O3溶解,Fe2O3不反应,然后过滤,滤液甲中含有NaAlO2、NaOH、Na2SiO3,甲中加入过量稀盐酸,NaAlO2、NaOH、Na2SiO3和稀盐酸反应后生成NaCl、AlCl3、H2SiO3,过滤后的溶液中含有NaCl、AlCl3、HCl,滤液乙中加入过量氨水,生成Al(OH)3沉淀和NH4Cl,过滤将氢氧化铝灼烧得到Al2O3.
解答 解:(1)减少生成物浓度平衡正向移动,加入焦炭消耗反应生成的氧气,使平衡向着正反应方向移动,故答案为:加入焦炭消耗反应生成的氧气,使平衡向正反应方向移动;
(2)所生成的气体X为CO2,检验方法为将气体通入澄清石灰水中,若澄清石灰水变浑浊,则说明生成的气体X为CO2,
故答案为:将气体通入澄清石灰水中,若澄清石灰水变浑浊,则说明生成的气体X为CO2;
(3)加入铝粉,可将FeCl3还原为熔点较高的FeCl2.在提纯时可避免AlCl3中混有FeCl3,化学方程式为Al+3FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3+3FeCl2,
故答案为:Al+3FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$AlCl3+3FeCl2;
(4)铝土矿加入过量NaOH可将SiO2、Al2O3溶解,Fe2O3不反应,然后过滤,滤液甲中含有NaAlO2、NaOH、Na2SiO3,甲中加入过量稀盐酸,NaAlO2、NaOH、Na2SiO3和稀盐酸反应后生成NaCl、AlCl3、H2SiO3,过滤后的溶液中含有NaCl、AlCl3、HCl,滤液乙中加入过量氨水,生成Al(OH)3沉淀和NH4Cl,过滤将氢氧化铝灼烧得到Al2O3;
①铝土矿中加入过量NaOH溶液,其中Al2O3和SiO2与NaOH反应,生成可溶的NaAlO2和Na2SiO3存在滤液甲中,还有未反应的NaOH,故答案为:NaOH、NaAlO2、Na2SiO3;
②滤液乙中加入过量氨水的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
③工业上采取电解熔融Al2O3的方法获得金属铝,化学方程式为2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$ 4Al+3O2↑,
故答案为:电解法;2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$ 4Al+3O2↑.
点评 本题考查物质制备,为高频考点,涉及物质制备、物质分离和提纯、金属冶炼、物质检验等知识点,明确元素化合物性质、物质分离提纯方法等知识点是解本题关键,注意:工业上用电解熔融氧化铝的方法冶炼Al,不能用电解氯化铝的方法冶炼Al,因为熔融状态下氯化铝不导电.


科目:高中化学 来源: 题型:解答题
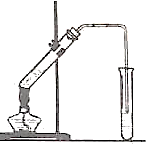 如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为可逆反应,不可能进行到底,即乙醇的转化率一定达不到100% | |
| B. | 乙酸挥发,导致其量减少,乙醇过量,不能充分转化为乙酸乙酯 | |
| C. | 产物不稳定,易被氧化为其他物质而影响乙醇的转化率 | |
| D. | 馏出物导入饱和碳酸钠溶液液面上,有较多的乙酸乙酯溶解于水溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件.| 物质 | 沸点/°C | 密度/g?cm-3 |
| 乙醇 | 78.0 | 0.79 |
| 乙酸 | 117.9 | 1.05 |
| 乙酸乙酯 | 77.5 | 0.90 |
| 异戊醇 | 131 | 0.8123 |
| 乙酸异戊酯 | 142 | 0.8670 |
| 实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生中和反应 | 不反应 | 溶解 | 生成氢气 |
| B | 不反应 | 有银镜反应 | 有红色沉淀 | 放出氢气 |
| C | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 641.0 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com