
| A. | 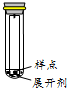 | B. |  | C. | 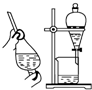 | D. | 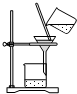 |
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:解答题
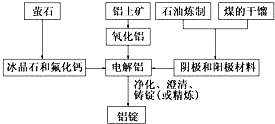 如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:
如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO | C. | CH4 | D. | 煤气(CO和H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
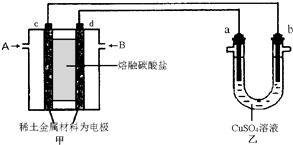
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酯类物质是形成水果香味的主要成分 | |
| B. | 油脂的皂化反应生成脂肪酸和丙醇 | |
| C. | 蛋白质的水解产物都含有醛基和氨基 | |
| D. | 糖类化合物都具有相同的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
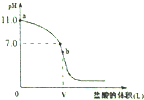 常温时,向浓度为0.1mol/L体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而变化的滴定曲线如图所示,b点表示两种溶液恰好完全反应.
常温时,向浓度为0.1mol/L体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而变化的滴定曲线如图所示,b点表示两种溶液恰好完全反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  除去CO的CO2 | B. |  萃取时振荡混合液 | ||
| C. |  稀释浓硫酸 | D. |  向试管中滴加液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com