
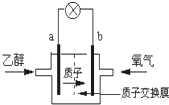
| A.a极为电池的正极 |
| B.电池工作时电流由a极沿导线经灯泡再到b极 |
| C.电池正极的电极反应为:4H++O2+4e-═2H2O |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
科目:高中化学 来源:不详 题型:单选题
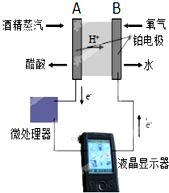
| A.该检测装置实现了将化学能转化为电能,且单位时间内通过电量越大,酒精含量越高 |
| B.电极A的反应:H2O+C2H5OH-4e-=CH3COOH+4H+ |
| C.电极B是正极,且反应后该电极区pH值减小 |
| D.电池反应:O2+C2H5OH=CH3COOH+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.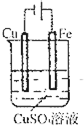 连接好并放置片刻后,铁片会镀上一层铜 |
B.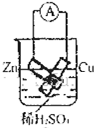 连接好导线后(片与片相接触),电流表会发生明显偏转 |
C.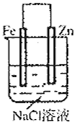 连接好并放置片刻后,在Zn片附近加一滴酚酞溶液,溶液变为红色 |
D.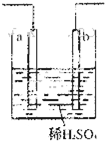 发生反应为Fe+2H+═Fe2++H2↑时,a、b可能是同种材料的电板 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
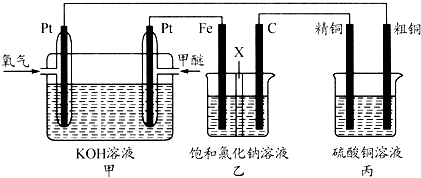
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
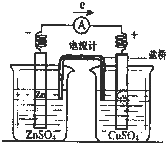
| A.铜片上有红色物质附着 |
| B.取出盐桥后,电流计依然发生偏转 |
| C.反应中,盐桥中的K+会移向CuSO4溶液 |
| D.锌片上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42 | 2560 | Br- | 64 |
| Mg2+ | 1272 | | |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com