
 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$ +2H2O.
+2H2O. 分析 (1)乙醇发生消去反应生成乙烯;
(2)在浓硫酸作催化剂条件下加热乙醇和乙酸发生酯化反应生成乙酸乙酯;
(3)根据卤代烃消去的条件解答,2-溴丙烷与NaOH水溶液发生取代反应生成丙醇;
(4)苯与浓硝酸浓硫酸混合共热制取硝基苯,苯环上的H被硝基取代,苯与浓硝酸、浓硫酸的混合物在100~110℃时发生取代反应生成间-二硝基苯;
解答 解:(1)乙醇发生消去反应生成乙烯,反应为CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O,发生的反应是消去反应,故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$C2H4↑+H2O;消去反应;
(2)在浓硫酸作催化剂条件下加热乙醇和乙酸发生酯化反应生成乙酸乙酯,反应的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,反应过程中乙酸断裂的是碳氧键,乙醇断裂的是氢氧键,故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;碳氧;氧氢;
(3)卤代烃在碱性水溶液加热条件下发生取代反应,由2-溴丙烷变成2-丙醇,方程式为CH3CHBrCH3+NaOH$\stackrel{△}{→}$CH3CHOHCH3+NaBr,此反应将卤代烃类物质转化为醇类物质,
故答案为:CH3CHBrCH3+NaOH$\stackrel{△}{→}$CH3CHOHCH3+NaBr,醇;
(4)苯与浓硝酸、浓硫酸的混合物在100~110℃时发生取代反应生成间-二硝基苯,反应的方程式为 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$ +2H2O,
+2H2O,
故答案为: +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$ +2H2O.
+2H2O.
点评 本题考查有机反应的化学方程式的书写,掌握常见有机物的性质是解答的关键,该题易错点为卤代烃取代和消去反应的条件,题目难度中等.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 途径① | B. | 途径② | C. | 途径③ | D. | 途径④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶 液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
| 醋酸浓度 (mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
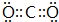 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:金刚石>食盐>干冰 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 沸点:HF>HBr>HCl | D. | 离子半径:Na+<Mg2+<Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
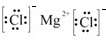 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的物质的量之比为1:3:2 | |
| B. | X、Y、Z的浓度不再发生变化 | |
| C. | 单位时间内生成2n mol Z,同时消耗3n mol Y | |
| D. | 单位时间内消耗n mol X,同时消耗3n mol Y |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溴乙烷与氢氧化钠水溶液共热 | |
| B. | 溴乙烷与氧氧化钠的乙醇溶液共热 | |
| C. | 甲烷与氯气反应 | |
| D. | 乙炔与氯化氢在一定条件下制氯乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com