
下列叙述正确的是
A.合成氨的“造气”阶段会产生废气
B.电镀的酸性废液用碱中和后就可以排放
C.电解制铝的过程中,作为阳极材料的无烟煤不会消耗
D.使用煤炭转化的管道煤气比直接燃煤可减少环境污染
科目:高中化学 来源: 题型:
请订正下面的错误。
(1)硫在足量氧气中燃烧:2S+3O2===2SO3。
________________________________________________________________________。
(2)AlCl3溶液呈酸性的原因:Al3++3H2O===Al(OH)3↓+3H+。
________________________________________________________________________。
(3)NaOH溶液与稀硫酸反应的离子方程式:2H++2OH-===2H2O。
________________________________________________________________________。
(4)工业合成氨反应:N2+3H2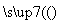 2NH3。
2NH3。
___________________________________ _____________________________________。
_____________________________________。
(5)工业上用氧化铝为原料制备金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
________________________________________________________________________。
(6)NH4Cl溶液和NaOH溶液加热反应:NH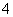 +OH-NH3·H2O。
+OH-NH3·H2O。
________________________________________________________________________。
(7)钢铁吸氧腐蚀,正极的电极反应:O2+2H2O===4OH-+4e-。
________________________________________________________________________。
(8)实验室制取氯气的离子方程式:MnO2+4HCl===MnCl2+Cl2↑+2H2O。
________________________________________________________________________。
(9)铜与浓硝酸反应:Cu+4HNO3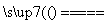 Cu(NO3)2+2NO2↑+2H2O。
Cu(NO3)2+2NO2↑+2H2O。
________________________________________________________________________。
(10)1 g肼气体燃烧生成氮气和水蒸气,放出热量16.7 kJ。反应的热化学方程式:
N2H4+O2===N2+2H2O ΔH=+16.7 kJ。
________________________________________________________________________。
(11)用惰性电极电解硫酸铜溶液的离子方程式
2Cu2++4OH-===2Cu+O2↑+2H2O。
________________________________________________________________________。
(12)Ba(OH)2溶液与稀硫酸反应的离子方程式:
Ba2++OH-+H++SO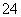 ===BaSO4↓+H2O。
===BaSO4↓+H2O。
________________________________________________________________________。
(13)铝—海水电池的负极反应式:Al-3e-+4OH-===[Al(OH)4]-。
________________________________________________________________________。
(14)碳酸氢钠在水中电离:NaHCO3 Na++H++CO
Na++H++CO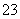 。
。
________________________________________________________________________。
(15)HCO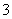 的水解方程式:HCO
的水解方程式:HCO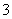 +H2O
+H2O H3O++CO
H3O++CO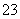 。
。
________________________________________________________________________。
(16)NaHSO4熔化时电离方程式:NaHSO4===Na++H++SO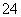 。
。
________________________________________________________________________。
(17)NH4Cl溶液呈酸性的原因:NH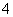 +H2O
+H2O NH4OH+H+。
NH4OH+H+。
________________________________________________________________________。
(18)铜与浓硫酸反应:Cu+2H2SO4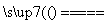 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
__________________________________________________________ ______________。
______________。
(19)NH4Cl固体和消石灰加热制NH3:2NH4Cl+Ca(OH)2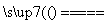 CaCl2+2NH3↑+H2O。
CaCl2+2NH3↑+H2O。
________________________________________________________________________。
(20)实验室制Cl2:4HCl(浓)+MnO2===MnCl2+Cl2↑+2H2O。
_______________________________________________________ _________________。
_________________。
(21)实验室利用H2O2分解制O2:2H2O2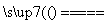 2H2O+O2↑。
2H2O+O2↑。
____ ____________________________________________________________________。
____________________________________________________________________。
(22)1 g氢气在足量氧气中燃烧生成液态水时,放出热量142.9 kJ,热化学方程式可表示为
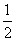 H2(g)+
H2(g)+ O2(g)
O2(g)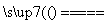
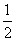 H2O(l) ΔH=-142.9 kJ。
H2O(l) ΔH=-142.9 kJ。
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca5(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。
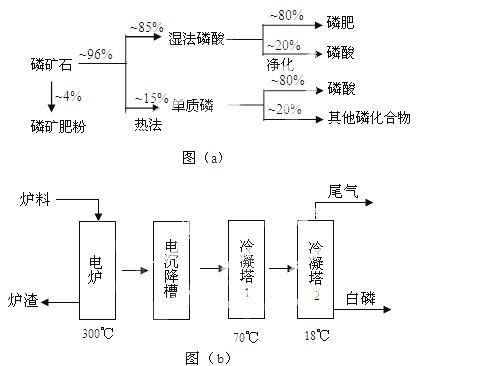
部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 ℅。
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:  。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品
。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品 磷酸 吨。
磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式)冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾 气先通入纯碱溶液,
气先通入纯碱溶液, 可除去
可除去 
再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是:  。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨的流程示意图如下:
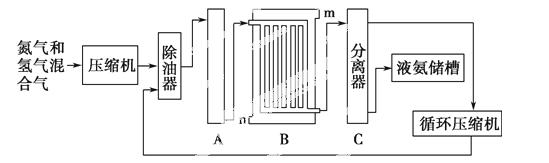
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是________、________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学方程式_______________________。
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是________,其中发生的化学反应方程式为____________。
(3)设备B的名称为________,其中m和n是两个通水口,入水口是________(填“m”或“n”)。不宜从相反方向通水的原因是______________。
(4)设备C的作用是______________________。
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
已知1 000 K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中c(H2O)∶c(CO)不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
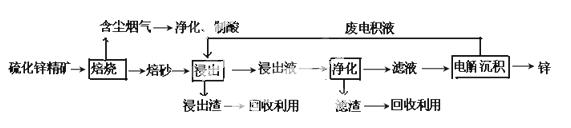
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是____。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为___________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤 炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即
炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即 倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉
倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉 甘石的主要成分为碳酸锌,倭铅是指金属锌)
甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
(1)电镀时,用镀层金属作阳极的作用是____________________________________。为了使镀层厚度均匀、光滑致密、与镀件的附着力22____。
(2)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是__________________,目的是_________________。
②上述提取镁的流程中,为了降低成本,减少污染,可以采取很多措施,请写出其中一点________________________________________________________________________。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
(3)铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+,而不吸附其他元素。其反应原理为____________________________________
________________________________________________________________________(树脂用HR代替),
发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为________________________________________________________________________
________________________________________________________________________。
(4)阿司匹林(COOHOOCCH3) 在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:______________
在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:______________
________________________________________________________________________,
此反应的类型属于________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知原子序数依次递增的5种非金属元素,A的原子半径在所有原子中最小,B元素组成的化合物种类最多,C的最外层电子数是内层电子数的3倍,且与B同周期,D与B同主族,E在C的下一周期,且是同周期元素中非金属性最强的元素。
回答下列问题:
(1)由A、B、C、E四种元素中的两种元素可形成多种分子,下列分子①BC2 ②BA4 ③A2C2 ④BE4,其中属于极性分子的是________(填序号)。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是_______________。
(3)B、C两元素都能和A元素组成两种常见的溶剂,其分子式为________、________。DE4在前者中的溶解性________(填“大于”或“小于”)在后者中的溶解性。
(4)BA4、BE4和DE4的沸点从高到低的顺序为_________________(填化学式)。
(5)A、C、E三种元素可形成多种含氧酸,如AEC、AEC2、AEC3、AEC4等,以上列举的四种酸其酸性由强到弱的顺序为______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
决定物质性质的重要因素是物质结构,请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中 重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因
重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因
。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3 401 |
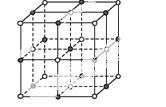
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填序号)。
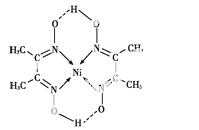
A.离子键 B.极性键
C.金属键 D.配位键
E.氢键 F.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
A.体积 相等时密度相等 B.原子数相等时具有的中子数相等
相等时密度相等 B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com