
| A. | 苯酚钠溶液中通少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | 向Ca(ClO)2溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O═CaSO4↓+2H++Cl-+HClO | |
| C. | 用新制的氢氧化铜悬浊液检验乙醛中的醛基:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 在碳酸氢钙溶液中加入过量的氢氧化钙溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
分析 A.二者反应生成苯酚和碳酸氢钠;
B.二氧化硫过量,反应生成硫酸钙、盐酸和硫酸;
C.氢氧化铜氧化醛基生成羧酸根离子;
D.二者反应生成碳酸钙和水.
解答 解:A.苯酚钠溶液中通少量CO2,离子方程式:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故A正确;
B.漂白粉溶液中通入过量SO2的离子反应为:Ca2++2ClO-+2H2O+2SO2=CaSO4↓+4H++2Cl-+SO42-,离子反应错误,故B错误;
C.用新制的氢氧化铜悬浊液检验乙醛中的醛基,离子方程式:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O,故C正确;
D.在碳酸氢钙溶液中加入过量的氢氧化钙溶液,离子方程式:Ca2++OH-+HCO3-═CaCO3↓+H2O,故D正确;
故选:B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 大理石与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| C. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 硫酸与氢氧化钡溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2000kJ | B. | △H=-2000kJ/mol | C. | △H=-1500kJ/mol | D. | -2000kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金属A投入B的盐溶液,A溶解说明A的金属性比B的金属性强 | |
| B. | 氯碱工业和金属钠的冶炼都用到了NaC1,在电解时它们的阴极都是Na+得电子 | |
| C. | 向硫酸溶液中加入适量氨水,当溶液中c(SO42-)=c(NH4+)时,溶液呈酸性 | |
| D. | 等物质的量浓度的下列溶液中①NH4Cl ②NH4Al(SO4)2 ③NH3•H2O ④CH3COONH4,c(NH4+)由大到小的顺序是:①>②>③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气中电子式为${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$的分子含量过多会造成温室效应 | |
| B. | 结构示意图为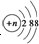 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为 的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-Na+和H${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H的两种化合物均为常见的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
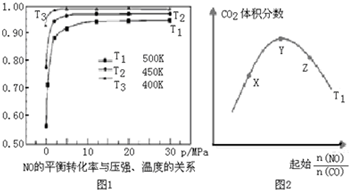
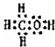 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| B. | 过量铁粉溶于稀硝酸:Fe+NO3-+4H+═Fe3++2H2O+NO↑ | |
| C. | 氯气与水的反应:H2O+Cl2═2H++Cl-+ClO- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,使沉淀物质的量最大:2Al3++3 Ba2++3SO42-+6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com