
| ① | A1 | B1 | C1 | D1 |
| 电子数 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 电子数 | 10 | 10 | 10 | 18 |
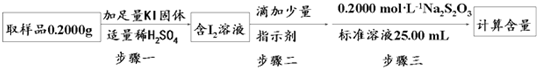
 ,
, ;
;

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
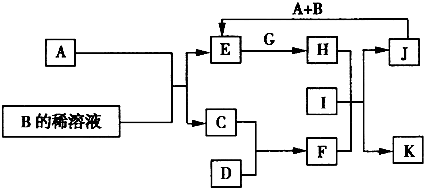
 A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:
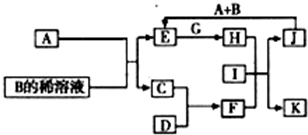
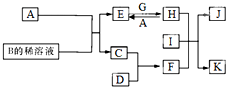 A~L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,可使湿润的红色石蕊试纸变蓝.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A~L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,可使湿润的红色石蕊试纸变蓝.G和I分别由相同的两种元素组成,通常状况下均为无色液体.查看答案和解析>>
科目:高中化学 来源:2010-2011学年东北师大附中、哈师大附中,辽宁实验中学三校高三第二次联合模拟考试(理综 题型:填空题
A~L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去)。已知A为金属单质,C、D通常状况下为气体单质。B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L。G和I分别由相同的两种元素组成,通常状况下均为无色液体。
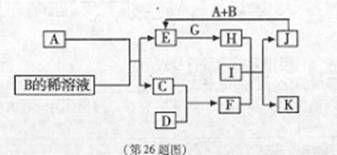
(1)B的化学式为 ;工业上冶炼金属A的方法称为 。
(2)向E的溶液中加入氢氧化钠溶液的实验现象为 ,反应的化学方程式为 。
(3)写出E的酸性溶液与G反应转化为H的离子方程式 。
(4)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为K L(用“>”、“<”或“=”表示),其主要原因是(用化学用语说明) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com