
����Ŀ������ϩ����Ҫ�Ļ���ԭ�ϡ���ʵ�����Ʊ��������£�
�ش��������⣺
����ϩ���Ʊ����ᴿ
��1��ԭ��FeCl3��6H2O������FeCl2���ʣ����鷽��Ϊ��ȡһ�����ĸ���Ʒ�����Һ������__________ (�ѧʽ) ��Һ������Ϊ__________��
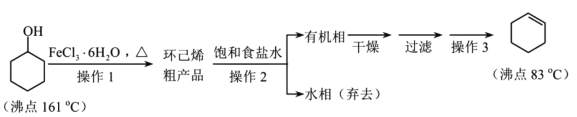
��2������1��װ����ͼ��ʾ�����Ⱥͼг�װ������ȥ����
��Ũ����Ҳ�����÷�Ӧ�Ĵ�����ѡ��FeCl3��6H2O������Ũ�����ԭ��Ϊ___������ţ���
a Ũ������ʹԭ��̼��������SO2
b FeCl3��6H2O��ȾС����ѭ��ʹ�ã�������ɫ��ѧ����
c ͬ�������£���FeCl3��6H2O��Ũ�����ƽ��ת���ʸ�
������B������Ϊ____________��
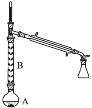
��3�����в��������У�����2����ʹ�õ���________�����ţ���
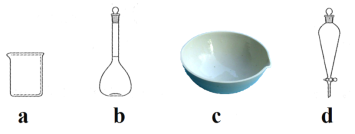
��4��������3�����IJ��貹�룺��װ����װ�ã��������������ʺͷ�ʯ��________������ţ���
����ȥǰ��֣��ռ�83�����֢ڼ��Ȣ�ͨ����ˮ
����ϩ�����IJⶨ
��һ�������£���a g����ϩ��Ʒ�м���b mol Br2����ַ�Ӧ����������Һ�м���������KI������c mol/L��Na2S2O3����Һ�ζ�����Һ���յ�ʱ����Na2S2O3����Һv mL���������ݾ��ѿ۳��������أ��� [��֪��![]() ]
]
��5���ζ�����ָʾ��Ϊ____________����Ʒ�л���ϩ����������Ϊ____________������ĸ��ʾ����
��6�������ζ���ɺ����ζ��ܼ��촦�������ݻᵼ�����ղⶨ�Ļ���ϩ����ƫ__________����������������������
���𰸡�K3[Fe(CN)6] ������ɫ���� ab ���ٻ����������� ad �ۢ� �� ������Һ 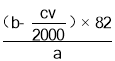 ��
��
��������
������������ȥ��Ӧ���ɻ���ϩ��ˮ������ϩ������ˮ������ʳ��ˮ�ܽ�������Ȼ�����Ȼ���Һ�õ���ˮ���к��л��������Ȼ������õ����л����к��л���ϩ��Ȼ�������ˡ�����õ�����ϩ��
(1)��������ͨ����K3[Fe(CN)6]��Һ���飻
(2)��Ũ�������ǿ�����ԣ�������ԭ�ϣ���FeCl36H2O��ȾС����ѭ��ʹ�ã�
������B������������������
(3)����2Ϊ��Һ�����ݷ�Һ����������������������
(4)������3����������������������
(5)����������Һ����ɫ�����Կ����õ�����Һ����⣻��Br2+2KI�TI2+2KBr����I2+2Na2S2O3�T2NaI+Na2S4O6�ù�ϵʽBr2��I2��2Na2S2O3������KI��Ӧ��n(Br2)��![]() n(Na2S2O3)��
n(Na2S2O3)��![]() ��cv��10��3 mol�������뻷��ϩ��Ӧ��n(Br2)��(b��
��cv��10��3 mol�������뻷��ϩ��Ӧ��n(Br2)��(b��![]() ��cv��10��3 )mol������
��cv��10��3 )mol������![]() ��n(����ϩ)��(b��
��n(����ϩ)��(b��![]() ��cv��10��3 )mol��m(����ϩ)��(b��
��cv��10��3 )mol��m(����ϩ)��(b��![]() ��cv��10��3 )mol��82g/mol����ϻ���ϩ����������
��cv��10��3 )mol��82g/mol����ϻ���ϩ����������![]() ���㣻
���㣻
(6)���ζ��ܼ��촦�������ݣ�������Na2S2O3����Һ���ƫС��������Ļ���ϩ�����ʵ���ƫ�ⶨ���ƫ�ߡ�
������������ȥ��Ӧ���ɻ���ϩ��ˮ������ϩ������ˮ������ʳ��ˮ�ܽ�������Ȼ�����Ȼ���Һ�õ���ˮ���к��л��������Ȼ������õ����л����к��л���ϩ��Ȼ�������ˡ�����õ�����ϩ��
(1)ԭ��FeCl36H2O������FeCl2���ʣ����鷽��Ϊ��ȡһ�����ĸ���Ʒ�����Һ������K3[Fe(CN)6]��Һ������ɫ������֤����FeCl2���ʣ�
(2)��a��Ũ�������ǿ�����ԣ���ʹԭ��̿��������SO2���Ӷ����ͻ���ϩ���ʣ���a��ȷ��
b��FeCl36H2O��ȾС����ѭ��ʹ�ã�������ɫ��ѧ�����b��ȷ��
c������ֻӰ�췴Ӧ���ʲ�Ӱ��ƽ���ƶ������Դ�����Ӱ����ʣ���c����
�ʴ�Ϊ��ab��
������B�������������������ɼ��ٻ��������������Ӷ�������������ʣ�
(3)����2���ڷ��뻥�����ܵ�Һ�壬��������Ϊ��Һ����Һ�õ��IJ��������з�Һ©�����ձ�������������ƿ����������ѡad���ʴ�Ϊ��ad��
(4)������3(����)�IJ��跶Χ����װ����װ�ã��������������ʺͷ�ʯ��ͨ����ˮ�����ȣ���ȥǰ��֣��ռ�83�����֣��ʴ�Ϊ���ۢڢ٣�
(5)����������Һ����ɫ�����Կ����õ�����Һ����⣬����ѡȡ���Լ�Ϊ������Һ����Br2+2KI�TI2+2KBr����I2+2Na2S2O3�T2NaI+Na2S4O6�ù�ϵʽBr2��I2��2Na2S2O3������KI��Ӧ��n(Br2)��![]() n(Na2S2O3)��
n(Na2S2O3)��![]() ��cv��10��3 mol�������뻷��ϩ��Ӧ��n(Br2)��(b��
��cv��10��3 mol�������뻷��ϩ��Ӧ��n(Br2)��(b��![]() ��cv��10��3 )mol������
��cv��10��3 )mol������![]() ��n(����ϩ)��(b��
��n(����ϩ)��(b��![]() ��cv��10��3 )mol��m(����ϩ)��(b��
��cv��10��3 )mol��m(����ϩ)��(b��![]() ��cv��10��3 )mol��82g/mol������ϩ��������Ϊ��
��cv��10��3 )mol��82g/mol������ϩ��������Ϊ�� ��
��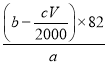 ��
��
(6)�����ζ���ɺ����ζ��ܼ��촦�������ݣ����¶����ı�Һ���ƫС��������ı�Һ���vƫС�����ݻ���ϩ����������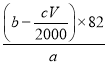 ��֪�����ղⶨ�Ļ���ϩ����ƫ�ߡ�
��֪�����ղⶨ�Ļ���ϩ����ƫ�ߡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ����
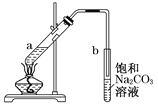
A. ��a�Թ����ȼ���Ũ���ᣬȻ���ҡ���Թܱ����������Ҵ����ټӱ�����
B. �Թ�b�е������¶˹ܿڲ��ܽ���Һ���Ŀ���Ƿ�ֹʵ������в�����������
C. ʵ��ʱ�����Թ�a��Ŀ��֮һ�Ǽ�ʱ����������������ʹ��Ӧ���������������ķ����ƶ�
D. �Թ�b�б���Na2CO3��Һ��������������������������������������Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ������������������(�����е�����)��ѡ�õ��Լ���װ�þ���ȷ���� (���� )
�����Լ�:��KMnO4/H����NaOH��Һ ������Na2CO3��Һ��H2O ��Na ��Br2/H2O ��Br2/CCl4
����װ�ã�

ѡ�� | ���� | �Լ� | װ�� |
A | C2H6(C2H4) | �� | �� |
B | ��(����) | �� | �� |
C | CH3COOC2H5(CH3COOH) | �� | �� |
D | �ױ�(���ױ�) | �� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǿ����Դ���⣬��������ȡʳ�κ���Ĺ�����ͼ��ʾ����������������ǣ� ��
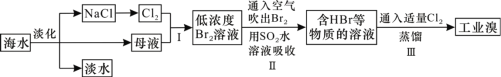
A.������ˮ�ķ�����Ҫ�������������������ӽ�����
B.��NaClΪԭ�Ͽ��������ռ��������ơ�����������Ȼ�����Ʒ
C.SO2ˮ��Һ����Br2�����ӷ�Ӧ����ʽΪBr2��SO2��2H2O=4H+��SO42-��2Br-
D.������й����ȿ��������壬����Ϊ���������ܶȱȿ������ܶ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ��ǽ��л�ѧ�о�����Ҫ���ߣ���ͼ��Ԫ�����ڱ���һ���֣����Т١������9��Ԫ�ء���ش��������⣺
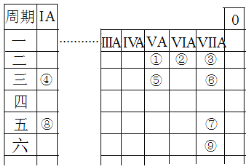
��1������Ԫ��������������Ӧ��ˮ�����������ǿ����___�������ʵĻ�ѧʽ����
��2������Ԫ�������ȶ��ļ��⻯����___�������ʵĻ�ѧʽ�������õ���ʽ��ʾ���γɹ��̣�___���ڢܢ��γɵ�1��1��1�ͻ�����ĵ���ʽΪ___��
��3�������ƶ���ȷ����___����ѡ����ĸ����
A.��ĵ��ʿ���Ϊ��ɫ����
B.��ĵ�������ˮ���ҷ�Ӧ��������
C.�١��ļ��⻯��֮�䷴Ӧ�IJ����мȺ����Ӽ��ֺ����Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.ͨ�����(ͬ��ͬѹ)�£����ʯ��ʯī�ȶ�
B.�ֽⷴӦ��һ���������ȷ�Ӧ
C.1mol CH3CH2CN��H2��һ����������ȫ�ӳɣ�����2mol H2
D.���³�ѹʱ��KOH��HCl����ϡ��Һ��ȫ��Ӧ���Ȼ�ѧ����ʽ��H��(aq)��OH��(aq)��H2O(l) ��H����57.3 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һԪ�� HA ����Һ�� KOH ��Һ��������(��������仯)��ʵ���������±���

�����жϲ���ȷ����( )
A.ʵ��ٷ�Ӧ�����Һ�У�c(K+)>c(A��)>c(OH��)>c(H+)
B.ʵ��ٷ�Ӧ�����Һ�У�c(OH��)��c(K+)��c(A��)��KW/1��10-9mol/L
C.ʵ��ڷ�Ӧ�����Һ�У�c(A��)+c(HA)>0.1 mol/L
D.ʵ��ڷ�Ӧ�����Һ�У�c(K+)��c(A��)>c(OH��)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�л���M��һ�������¿�ת��ΪN������˵����ȷ���ǣ� ��

A.�÷�Ӧ����Ϊȡ����Ӧ
B.������ˮ����M��N
C.N����������̼ԭ�ӹ�ƽ��
D.M��һ�ȴ��ﹲ7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����·�Ӧ�ɻ��������Դ������(![]() )������˵������ȷ����
)������˵������ȷ����
��![]()
![]()
��![]()
![]()
��![]()
![]()
��![]()
![]()
A. ��Ӧ�١���Ϊ��Ӧ���ṩԭ����
B. ��Ӧ��Ҳ��![]() ��Դ�����õķ���֮һ
��Դ�����õķ���֮һ
C. ��Ӧ![]() ��
��![]()
D. ��Ӧ![]() ��
��![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com